Fenolftaleín
Fenolftaleín je organická aromatická zlúčenina. Často sa používa pri acidobázických titráciách ako indikátor.
| Fenolftaleín | |||
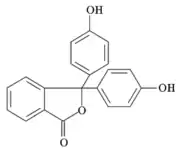 Fenolftaleín | |||
| Všeobecné vlastnosti | |||
| Sumárny vzorec | C20H14O4 | ||
| Synonymá | 3,3-bis(4-hydroxyfenyl)-1(3H)-izobenzofuranón | ||
| Vzhľad | bezfarebná tuhá látka | ||
| Fyzikálne vlastnosti | |||
| Molárna hmotnosť | 318,323 g/mol | ||
| Teplota topenia | 262,5 °C | ||
| Hustota | 1,277 g/cm3 (32 °C) | ||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||
Výroba
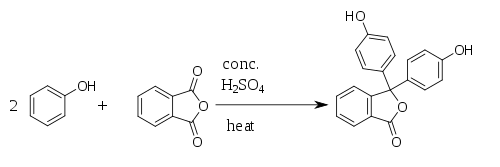
Fenolftaleín bol prvýkrát pripravený v roku 1871 nemeckým chemikom Adolf von Baeyerom reakciou fenolu s ftalanhydridom, z čoho pochádza názov fenolftaleín. Reakcia prebieha za katalýzy kyseliny sírovej a za tepla (nesmie dôjsť k prehriatiu, pretože by sa rozpadal ftalanhydrid). Pri reakcii vzniká ako vedľajší produkt voda.
Titrácie
Pri acidobázických titráciách sa využíva farebný prechod fenolftaleínu pri zmene pH. V kyslom prostredí je fenolftaleín bezfarebný, v bazickom prostredí sa sfarbuje do fialova. K prechodu dochádza pri pH 8,2-9,8. Fenolftaleín sa používa vo forme roztoku v etanole.
| Zlúčenina | In | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| Štruktúra | 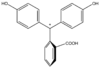 | 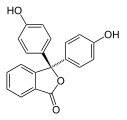 | 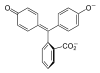 | 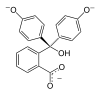 |
| Model |  |  | 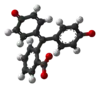 | 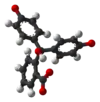 |
| pH | < 0 | 0−8.2 | 8.2−12.0 | >12.0 |
| Prostredie | silne kyslé | kyslé alebo skoro neutrálne | alkalické | silne alkalické |
| Farba | oranžová | ružová až fialová | bezfarebná | |
| Obrázok |  |  |
Využitie

Fenoltaleín sa používa ako preháňadlo. V súčasnej dobe sa od jeho použitia ustupuje z dôvodu možnej karcinogenity.
Fenolftaleín sa spoločne s peroxidom vodíka používa pri testovaní prítomnosti krvi, tzv. Kastle-Meyerov test.
Ďalšie použitie je pri výrobe hračiek, napr. miznúcich atramentov. Atrament sa zmieša s hydroxidom sodným, ktorý reaguje so vzdušným oxidom uhličitým. Pri reakcii vzniká uhličitan sodný a klesá pH atramentu. Pokles pH spôsobí prechod fenolftaleínu z fialovej do bezfarebnej formy.
Pozri aj
Zdroj
- Tento článok je čiastočný alebo úplný preklad článku Phenolphtalein na anglickej Wikipédii.