Titrácia
Titrácia je bežná laboratórna metóda kvantitatívnej analýzy.
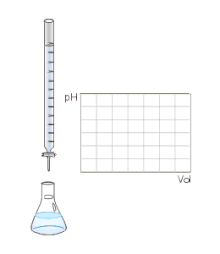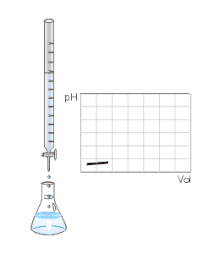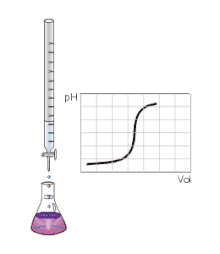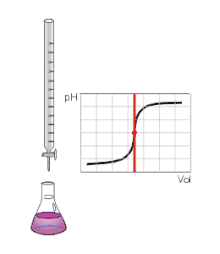
Zakladá sa na stanovení neznámej koncentrácie známeho objemu vzorky (titrandu) zmeraním objemu titračného štandardu (o známej koncentrácii), ktorý sme spotrebovali, aby látky práve a bez zvyšku zreagovali (tzv. bod ekvivalencie).
Aby sa jednoznačne a presne zistilo, kedy nastal bod ekvivalencie, väčšinou sa pridáva do titrovaného roztoku tzv. indikátor - látka, ktorá výrazne mení farbu podľa podmienok. Indikátory sú väčšinou buď selektívne (zafarbia sa podľa prítomnosti nejakej látky, napríklad škrob), alebo acidobazické (zafarbujú sa podľa pH). Niektoré ďalšie metódy určenia bodu ekvivalencie sú spektroskopia alebo konduktometria.
Titrácie sa obyčajne robia štyrikrát, z toho prvý pokus je len orientačný.
Druhy titrácií
Acidobázické
- Alkalimetrické stanovenie odmerným roztokom silnej zásady (NaOH,KOH)
- Acidimetrické stanovenie odmerným roztokom silnej kyseliny (HCl,H2SO4)
Komplexotvorné
- Chelátometria, najčastejšie chelačným činidlom kyselinou etyléndiaminotetraoctovou (EDTA)
- Merkurimetria, odmerným roztokom je dusičnan ortuťnatý
Oxidačno-Redukčné
- Manganometria, odmerným roztokom je manganistan draselný, ktorý je zároveň indikátorom
- Jodometria, odmerný roztok tiosíranu sodného pri stanovení oxidovadiel, alebo vodný roztok elementárneho jódu pokiaľ sa stanovujú redukovadlá
- Bromátometria, odmerným roztokom je roztok bromičnanu draselného
- Bichrómatometria, odmerným roztokom je roztok dichrómanu draselného
- Cerimetria, odmerný roztok síranu ceričitého v kyseline sírovej
- Titanometria, chlorid titanitý v HCl je odmerným roztokom
Titrácie založené na zrážacích reakciách
- Gravimetria - jedna z mála priamych metód stanovenia
- Argentometria, stanovenie chloridov odmerným roztokom dusičnanu strieborného
Spätná titrácia meria, koľko zostalo zo známeho množstva pridanej látky, s ktorou zreagovala meraná vzorka.
Podľa reakcie rozlišujeme druhy titrácie: acidobazické (indikátory: fenolftaleín, metylová oranžová), redoxné (rôzne selektívne indikátory), komplexotvorné (indikátory: murexid apod.)
Pre acidobázické titrácie je charakteristická titračná krivka (závislosť pH na pridanom objeme štandardu), ktorá v bode ekvivalencie prudko zmení hodnotu a inak je pomerne stála. Pre viacsytné kyseliny je takých „schodov“ viac, každý zodpovedá danému počtu väzieb.
Príklad
Zadanie
Titer: Roztok NaOH, Titračný štandard: Roztok HCl
- V(HCl) = 12 ml = 0,012 dm3 (objem spotrebovaný pri titrácii)
- c(HCl) = 0,1 mol/dm3
- V(NaOH) = 10 ml = 0,01 dm3
- c(NaOH) = ? mol/dm3
Výpočet
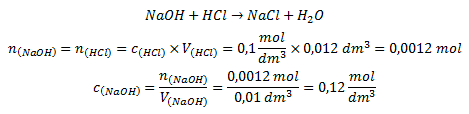
| Chemický portál |