Elektrofilná aromatická substitúcia
Elektrofilná aromatická substitúcia je chemická reakcia, v ktorej sa na aromatický uhľovodík zavádzajú rôzne funkčné skupiny.
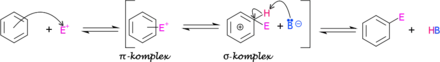
Mechanizmus
Všeobecne sa dá popísať mechanizmus elektrofilnej aromatickej substitúcie ako reakcia elektrofilu s aromatickým uhľovodíkom. Elektrofil najprv reaguje s π-elektrónmi aromatického uhľovodíka a naviaže sa na ne. Vzniká takzvaný π-komplex. Tento π-komplex vzniká relatívne rýchlo, pretože aromatické uhľovodíky majú dostatok π-elektrónov s ktorými rýchlo reaguje elektrofil. Elektrofil sa postupne naviaže na samotné aromatické jadro. Tým vzniká takzvaný σ-komplex. Tento proces je relatívne pomalý, pretože je potrebné zrušiť väzbu v π-komplexe. Po utvorení σ-komplexu prichádza do reakcie báza, ktorá svojím elektrónovým párom naviaže vodík; tým sa celý systém stabilizuje a vzniká konečný produkt.
Rozdelenie
Elektrofilná aromatická substitúcia sa podľa druhu elektrofilu delí na nitráciu, sulfonáciu, halogenáciu, alkyláciu a acyláciu.[1]
Nitrácia
Nitrácia je zavádzanie -NO2 skupiny na zlúčeninu. Na nitráciu sa využíva nitračná zmes, čo je zmes kyseliny dusičnej a kyseliny sírovej.
Dvojité substitúcie benzénu
Substituovať sa môže aj už substituovaná látka. Vlastnosti druhotnej substitúcie závisia od druhu substituenta, ktorý sa na benzéne už nachádza.[2]
Ovplyvnenie reaktivity
Substituent na benzéne ovplyvňuje mimo iného aj reaktivitu. Niektoré skupiny aktivujú benzén, to znamená, že bude v porovnaní z nesubstituovaným benzénom reaktívnejší. Iné naopak benzén deaktivujú. Vo všeobecnosti možno povedať, že substituent ktorý odťahuje elektróny z benzénu je deaktivujúci a substituent ktorý ich pridáva je aktivujúci. Substituent môže pridávať alebo odoberať elektróny pomocou dvoch efektov: indukčného a mezomérneho.
Ovplyvnenie polohovej aktivity
Substituent na benzéne taktiež ovplyvňuje polohu do ktorej bude ďalší substituent zavedený. Na benzéne rozoznávame tri rôzne polohy dvoch substituentov: orto(1,2) , meta(1,3) a para (1,4).
Polohu ovplyvňujú substituenty taktiež pomocou indukčného a mezomérneho efektu. Zvýšením elektrónovej hustoty na konkrétnom uhlíku sa v tom mieste zvýši reaktivita. Ako príklad možno použiť -OH skupinu. Voľný elektrónový pár hydroxylovej skupiny sa zapája do konjugácie s π-elektrónmi benzénu. Kyslík je elektronegatívnejší ako uhlík a tak priťahuje elektróny z benzénu. Mezomérny efekt konjugácie voľného elektrónového páru je však oveľa silnejší ako indukčný efekt kyslíka. Elektróny sa teda budú posúvať v smere šípok.
Takýmto posunom sa zvýši elektrónová hustota v orto a para polohe. Hydroxylová skupina je teda orto, para orientujúca. Keďže do benzénu dodáva elektróny, je aktivujúca.
Pomocou mezomérneho a indukčného efektu sa dajú odvodiť orientácie všetkých substituentov.
Aj napriek tomu, že teoreticky by substituenty mali vstupovať do určenej polohy, vznikajú zmesi produktov. Najväčšie zastúpenie v zmesi produktov bude mať teoreticky odvodený produkt.
Tabuľka
V nasledujúcej tabuľke sú uvedené niektoré substituenty a ich vlastnosti.[3]
| Substituent | Reaktivita | Orientácia | Indukčný efekt | Mezomérny efekt |
|---|---|---|---|---|
| -R | aktivujúci | orto, para | slabý donorný | žiadny |
| -OH, -NH2 | aktivujúci | orto, para | slabý akceptórny | silný donorný |
| -F, -Cl, -Br, -I | deaktivujúci | orto, para | silný akceptórny | slabý donorný |
| -N+(CH3)3 | deaktivujúci | meta | silný akceptórny | žiadny |
| -NO2, -CN, -CHO, -COOR, -COR, -COOH | deaktivujúci | meta | silný akceptórny | silný akceptórny |
Trojité substitúcie benzénu
Podobne ako monosubstituované zlúčeniny sa aj disubstituované zlúčeniny dajú ďalej substituovať. Vlastnosti o reaktivite a orientácii platia aj v tomto prípade, avšak je veľmi pravdepodobné, že pri substitúcii budú vznikať zmesi produktov vo väčšom pomere.[4]
Pozri aj
| Chemický portál |
Zdroje
- MCMURRY, John. Organická chemie. 6. vyd. [s.l.] : [s.n.]. ISBN 978-80-214-3291-8. S. 528.
- MCMURRY, John. Organická chemie. 6. vyd. [s.l.] : [s.n.]. ISBN 978-80-214-3291-8. S. 539-542.
- MCMURRY, John. Organická chemie. 6. vyd. [s.l.] : [s.n.]. ISBN 978-80-214-3291-8. S. 548.
- MCMURRY, John. Organická chemie. 6. vyd. [s.l.] : [s.n.]. ISBN 978-80-214-3291-8. S. 539.
.png.webp)
.png.webp)
.png.webp)
.png.webp)
.png.webp)
.png.webp)
.png.webp)