Nukleofilná substitúcia
Nukleofilná substitúcia je pomenovanie triedy chemických reakcií v organickej a bioorganickej chémii, kde atakujúce činidlo (nukleofil) vstupujúce do reakcie musí mať voľný elektrónový pár, pretože odstupujúca skupina (nukleofug) odchádza z pôvodnej väzby s dvojicou elektrónov. Nukleofug musí byť tiež nukleofilnej povahy, podľa pravidla, že odstupujúca skupina musí mať rovnakú povahu ako pristupujúce (atakujúce) činidlo. Nukleofilná substitúcia môže byť dobre využiteľná na zabranie miesta na alifatickom (saturovanom) uhlíku alebo (menej často) na aromatickom alebo iných saturovaných uhlíkových centrách. Všeobecný zápis reakcie je nasledovný:
- Nuc: + R-LG → R-Nuc + LG:
Elektrónový pár (:) na nukleofile atakuje substrát (R-LG), vytvárajúc novú väzbu, kým odstupujúca skupina (LG – leaving group, angl.) odchádza s elektrónovým párom. Hlavným produktom je v tomto prípade R-Nuc. Nukleofil môže byť elektricky neutrálny alebo negatívne nabitý, kým substrát je typicky neutrálny alebo pozitívne nabitý.
Príkladom nukleofilnej substitúcie je hydrolýza alkylbromidov (R-Br) v alkalickom prostredí, kde atakujúci nukleofil je OH− a odchádzajúca skupina je Br−.
- R-Br + OH− → R-OH + Br−
Nukleofilné substitučné reakcie
V organickej chémii existuje veľké množstvo reakcií, ktoré prebiehajú týmto mechanizmom. Bežné reakcie sú
- organická redukcia pomocou hydridu
- R-X → R-H použitím LiAlH4 (SN2)
- hydrolytická reakcia ako:
- R-Br + OH− → R-OH + Br− (SN2) alebo
- R-Br + H2O → R-OH + HBr (SN1)
- Williamsova syntéza
- R-Br + OR'− → R-OR' + Br− (SN2)
- Wenkerova syntéza, ktorá uzatvára kruh v aminoalkoholoch
- Finkelsteinova reakcia je reakcia výmeny halogenidu, avšak pri Perkovovej reakcii a Michaelisovej-Arbuzovej reakcii sa použije nukleofil s nukleofilným centrom na fosfore.
Nukleofilná substitúcia na saturovanom uhlíkovom centre
SN1 a SN2 reakcie
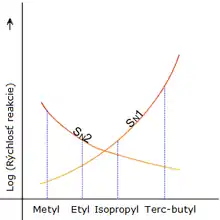
V roku 1953 Edward D. Hughes a sir Christopher Ingold študovali nukleofilnú substitúciu alkylhalogenidov a príbuzných zlúčenín. Zistili, že existujú dva hlavné mechanizmy účinku, pričom navzájom súťažia. Sú to SN1 reakcia a SN2 reakcia (S ako substitúcia, n ako nukleofilná a číslo vyjadruje kinetický rád reakcie).
Pri reakcii typu SN2 prebieha adícia nukleofilu a eliminácia odstupujúcej skupiny simultánne. Nastáva tam, kde je centrálny atóm ľahko dostupný pre nukleofil. Naproti tomu reakcia typu SN1 prebieha v dvoch stupňoch. Tento typ mechanizmu sa viac presadzuje vtedy, keď je centrálny uhlíkový atóm substrátu obklopený objemnými skupinami, pretože takéto skupiny stéricky interferujú s SN2 a pretože vysoko substituovaný uhlík vytvára stabilný karbkatión. Z počiatku bolo určenie triedy nukleofilnej substitúcie zložité, pretože sa riadilo postupnosťou derivátov uhľovodíkov: Reakčná kinetika sa mení postupne od prvého rádu k rádu druhému. Rády sú ovplyvnené odlišnými faktormi. SN1 reaktivita rastie v postupnosti (pre alifatické halogénderiváty) CH3-X < primárne < sekundárne < terciárne, zatiaľ čo SN2 rastie terciárne > sekundárne > primárne > CH3-X. Celková reaktivita je určená súčtom reaktivít dvoch rádov a platí poradie: CH3-X > primárne > terciárne > sekundárne.
| Tabuľka : Nukleofilná substitúcia na R-X (napr. halogénalkyl) | |||||||
|---|---|---|---|---|---|---|---|
| Ovplyvňujúci faktor | SN1 | SN2 | Poznámka | ||||
| Kinetika | Rád=k[RX] | Rád=k[RX][Nuc] | |||||
| Primárny alkyl | neprebieha, pokiaľ nie je stabilizovaný ďalšou skupinou |
prebieha dobre ak nie je bránená |
|||||
| Sekundárny alkyl | priemerná | priemerná | |||||
| Terciárny alkyl | výborná | neprebieha | možná eliminácia ak zahrejeme alebo použijeme silný nukleofil | ||||
| Odstupujúca skupina | významná | významná | pre halogenidy, I > Br > Cl >> F | ||||
| Nukleofilita | nepodstatná | podstatná | |||||
| Preferované rozpúšťadlo | polárne protické | polárne aprotické | |||||
| Stereochémia | racemizácia (+ možná čiastočná inverzia) |
inverzia | |||||
| Zmena usporiadania (karbkatiónu) | bežná | zriedkavá | bočná reakcia | ||||
| Eliminácia | bežná, hlavne s bázickými nukleofilmi |
len po zahriatí a s bázickými nukleofilmi |
bočná reakcia špec. po zahriatí | ||||
Ostatné mechanizmy
Popri SN1 a SN2 sú známe aj iné mechanizmy, ale nevyskytujú sa často. Mechanizmus SNi je pozorovaný v reakcií sulfinylchloridov s alkoholmi. Je takmer rovnaký ako SN1, s rozdielom prístupu nukleofilu z rovnakej strany ako odstupujúca skupina.
Nukleofilná substitúcia môže byť spojená s posunom dvojnej väzby, čo môžeme pozorovať napríklad vo Ferrierovom posune. Tento typ je nazývaný ako reakcie SN1' alebo SN2', podľa kinetiky. Napríklad pri reakcií allylhalogenidov alebo sulfonátov nukleofil môže atakovať γ nesaturovaný uhlík, namiesto uhlíka nesúceho odstupujúcu skupinu. Môžeme to pozorovať pri reakcií 1-chlorbut-2-énu s hydroxidom sodným, kde vzniká zmes 2-butén-1-olu a 3-butén-1-olu.
- CH3CH=CH-CH2-Cl +NaOH → CH3CH=CH-CH2-OH + CH3CH(OH)-CH=CH2
V anorganickej chémii sa ešte vyskytuje SN1CB mechanizmus.
Nukleofilná substitúcia na nesaturovanom uhlíkovom centre
Nukleofilná substiúcia mechanizmom Sn1 a Sn2 zvyčajne neprebieha u vinyl- a arylhalogenidov alebo príbuzných zlúčenín. Za istých okolností môže prebehnúť, ale cestou iných mechanizmov a pri špecifických podmienkach- zvyčajne vysoká teplota, tlak a použitie autoklávu. Ak sa má substituovať karbonylová skupina, acylová skupina môže podľahnúť takzvanej nukleofilnej acylovej substitúcii. Je to normálna cesta substitúcie s derivátmi karboxylových kyselín, ako acylchloridov, esterov a amidov.
Zdroje
- Devínsky F. a kol. Organická chémia pre farmaceutov. prvé vydanie. Martin: Vydavateľstvo Osveta, 2001. 750 strán. ISBN 80-8063-056-9
- Tento článok je čiastočný alebo úplný preklad článku Nucleophilic substitution na anglickej Wikipédii.
| Chemický portál |