Eliminácia (chémia)
Eliminácia je typ chemickej reakcie, pri ktorej sa odštiepia dva substituenty v dvoch krokoch reakčného mechanizmu. Prvý krok je známy ako E2 reakcia a druhý ako E1 reakcia. Číselné označenie nemá nič spoločné s krokmi reakcie, skôr s kinetikou reakcie.
Vo väčšine organických reakcií sa odštiepia vodíky na vytvorenie násobnej väzby- zvyšuje sa nenasýtenosť molekuly. Je taktiež možné, že reakcia prejde redukčnou elimináciou, pri ktorej valencia uhlíka sa zníži na dva. Najdôležitejšie sú však tie reakcie, ktoré zahŕňajú halogénuhľovodíky R-X s dobre odstupujúcimi skupinami, reagujúce s Lewisovými zásadami za vzniku alkénov. Eliminácia sa môže udiať aj ako zvratná reakcia ku adícii. Keď substrát je asymetrický, chiralita je určená podľa Zaitsevovho pravidla.
Mechanizmus E2
Počas 20-tych rokov 20. storočia, Sir Christopher Ingold narvhol model na vysvetlenie mechanizmu E2. E2 znamená bimolekulárnu elimináciu. Fundamentálne elementy reakcie sú nasledujúce:
- Jeden krok reakcie, pri ktorom väzby C-H a C-X sa prerušia za vzniku dvojitej väzby C=C, π-väzby
- E2 je jednokrokový proces eliminácie s jedným medziproduktom
- Najčastejšie východiskové látky sú primárne alebo sekundárne halogénuhľovodíky
- Rýchlosť reakcie ovplyvnená druhým poriadkom reakcie halogénuhľovodíka a bázy
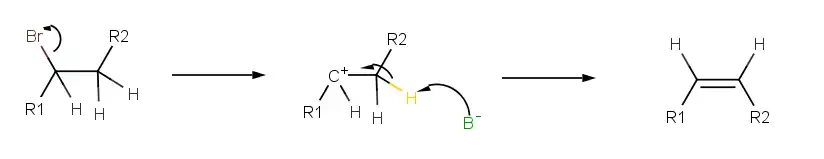
- Keďže E2 produktom mechanizmu je π-väzba, dve odchádzajúce skupiny (najčastejšie vodík a halogén) musia byť koplanárne (ležiace v tej istej rovine). Menej energetický trans- medziprodukt preskočí na energetickejšiu cis-konformáciu. Reakčný mechanizmus, zahŕňujúci preskočenú konformáciu, je priaznivejší pre E2 reakcie, na rozdiel od E1
- E2 najčastejšie využíva silnú bázu, ktorá musí mať dostačujúce silu na to, aby odštiepila veľmi slabo kyslý vodík
- Pri vzniku π-väzby sa mení hybridyzácia z sp3 na sp2
- Mechanizmus E2 je veľmi podobný mechanizmu substitúcie nukleofilnej Sn2
Mechanizmus E1
E1 je model na vysvetlenie zvláštneho typu eliminácie. E1 znamená unimolekulárnu elimináciu s nasledujúcimi špecifikami:
- Je to proces s dvoma krokmi:
- Ionizácia (väzba C-H sa štiepi za vzniku uhľovodíkového katiónu)
- Deprotonácia uhľovodíkového katiónu
- Väčšinou sa odohráva na terciárnych halogénuhľovodíkoch, ale je možná aj pri niektorých sekundárnych
- Rýchlosť reakcie je ovplyvnená len koncentráciou halogénuhľovodíka
- Reakcie zvyčajne prebieha za úplnej absencie bázy alebo za prítomnosti veľmi slabej bázy. Vyžaduje sa tu kyslé prostredie a vysoká teplota.
- E1 je konkurenčná reakcia s Sn1
- Trans-konformácia nie je potrebná

E1 eliminácie sa odohrávajú na vysokosubstituovaných halogénuhľovodíkoch z dvoch dôvodov:
- vysokosubstituované halogénuhľovodíky sú objemné, obmedzujúce priestor pre E2 mechanizmus, preto E1 mechanizmus je uprednostnený
- vysokosubstituované uhľovodíkové katióny sú stabilnejšie než metyl alebo primárne substituované katióny. K takejto stabilite dôjde v dvojkrokovej E1 eliminácii
- Ak Sn1 a E1 sú konkurenčné, E1 môže byť uprednostnená zvýšením tepla
E1cB reakcia
Na rozdiel od E1 reakcie, ktorá zahŕňa vznik uhľovodíkového katiónu, E1cB reakcia sa odohráva cez uhľovodíkový anión. Zásadou ovplyvnené odštiepenie vodíka v pomalom, rýchlosť obmedzujúcom kroku, ktorý vystrelí odstupujúcu skupinu na priľahlý uhlík. Reakcia má s E1 spoločné to, že obe majú ťažko odstupujúce skupiny, ako napr. OH-, dva uhlíky odstránené z karbonylovej skupiny HO-C-CH-C=O. Slabo odstupujúca skupina nesúhlasí s alternatívnymi E1 a E2 možnosťami a karbonylová skupina zvyčajne okysľuje vodík na α-uhlíku rezonančnou stabilizáciou prechodného aniónu. [1]

E2 eliminácia z vinylov: Ako pripraviť alkíny
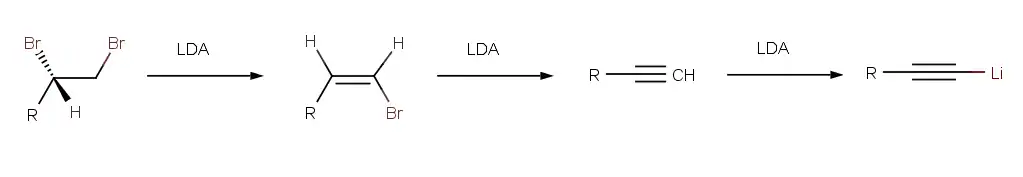
Vinylbromidy môžu byť sami a sebe pripravené elimináciou 1,2-dibromoalkánov. Pri reakcii s tromi ekvivaletmi LDA (Lítium diizopropylamín, teda silná báza) sa eliminuje na Vinylbromid a následne na alkín. Konečný alkín je bohato kyslý, aby mohol byt deprotonovaný tretím ekvivalentom LDA. V skutočnosti, produktom reakcie je acetylid lítia R-C≡C-Li+ pripravený na ďalšie reakcie. [2]
Špecifické eliminačné reakcie
Každá z týchto reakcií má špecifickú odstupujúcu skupinu:
- dehydrohalogenácia, odstupujúca skupina halogén
- dehydratácia, odstupujúca skupina je voda
- Bamford-Stevensova reakcia, odstupujúca skupina tosylhydrazón za katalýzy alkoxidom
- Copova reakcia, odstupujúca skupina amín oxid
- Hofmannovo odbúravanie, odstupujúca skupina kvartérna amónna soľ
- Chugaevova reakcia, odstupujúca skupina metyl xantát
- Griecova eliminácia, odstupujúca skupina selénoxid
- Shapirova reakcia, odstupujúca skupina tosylhydrazón za katalýzy alkyllítiom
- Hydrazónová jodidácia, odstupujúca skupina hydrazón za katalýzy jódom
- Grobova fragmentácia zvyšujúca stupeň nenasýtenosti jednej z odstupujúcich skupín
- Kornblum–DeLaMarova reakcia (eliminácia cez (H)C-O(OR) väzbu), odstupujúca skupina alkohol a jeho príslušný ketón
- Takaiova olefinácia s dvomi objemnými chrómovými skupina
Pozri aj
| Chemický portál |
Zdroje
- MCMURRY, John. Organic chemistry. 6. vyd. [s.l.] : [s.n.]. ISBN 978-80-214-3291-8. S. 393.
- CLAYDEN, Jonathan. Organic chemisrty. 1. vyd. [s.l.] : [s.n.]. S. 487.
- Tento článok je čiastočný alebo úplný preklad článku Elimination reaction na anglickej Wikipédii (číslo revízie nebolo určené).