Elektrochemický článok
Elektrochemický článok (staršie galvanický článok (v širšom zmysle)) je chemický zdroj elektrického napätia skladajúci sa z dvoch materiálov spojených elektrolytom. V praktickom prevedení je známy ako monočlánok. Delí sa predovšetkým na:
Dejiny elektrochemických článkov
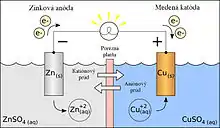
Galvanický článok dostal svoj názov podľa talianskeho lekára a prírodovedca Luigiho Galvaniho, ktorý v roku 1780 pri pitvaní žabích stehienok spozoroval ich zášklby po dotyku dvoch rozdielnych kovových predmetov na rôzne konce nervov, podobné zášklbom vyvolávaným elektrickým nábojom. Tento jav správne vysvetlil taliansky fyzik Alessandro Volta, a to vznikom elektrického napätia medzi dvoma kovmi (nástrojom a kovovým podkladom) vodivo prepojenými elektrolytom (obsiahnutým v bunkách). Na základe týchto úvah zostavil v roku 1800 článok, skladajúci sa z medenej a zinkovej elektródy ponorenej do roztoku kyseliny sírovej. Voltov článok dával napätie približne 1 V a stal sa prvým zdrojom stáleho elektrického prúdu, do tej doby sa elektrina vytvárala trením alebo indukčnou elektrinou. Objav Voltovho článku vydláždil cestu pre rozvoj skúmania elektrických javov.
Použitie elektrochemických článkov
Elektrochemické články sa používajú predovšetkým v prenosných elektrických spotrebičoch – baterkách, hodinkách, mobilných telefónoch, prenosných počítačoch, fotoaparátoch, kamerách, všade tam, kde sa spotrebič nedá pripojiť na elektrickú sieť alebo priamo použiť mechanický zdroj generátora. Ich nevýhodou môže byť nízke elektromotorické napätie, nízky výkon a krátka životnosť. Akumulátory sa dajú použiť aj na uloženie elektrickej energie, sú potrebné pri prerušení dodávky zo siete, napríklad v záložných zdrojoch alebo ako zdroj elektriny v stojacom automobile.
=
Elektrochemický článok v elektrickom obvode
Po zapojení článku do elektrického obvodu prebiehajú vo vnútri článku reakcie, ktorými sa postupne znižuje elektrická energia, článok sa vybíja. Tieto reakcie môžu byť nevratné – napätie článku sa po vybití nedá obnoviť (primárny elektrochemický článok) alebo vratné – článok sa dá znova nabiť (sekundárny elektrochemický článok = akumulátor).
Pri prechode elektrického prúdu článkom sa prejaví vnútorný odpor článku. Vnútorný odpor Ri má za následok zníženie napätia článku na svorkovom napätí U:
- , kde Ue je elektromotorické napätie, I je elektrický prúd (pri vyššom zaťažení – vyššom prúde – sa napätie článku viac zníži).
Elektrochemický článok je vždy zdroj jednosmerného prúdu. V elektrických obvodoch, kde záleží na smere prúdu, je treba pred zapojením skontrolovať správnu polaritu elektród.
Zloženie elektrochemických článkov
Pri zostavovaní elektrochemického článku sa pre elektródy a elektrolyty používa taká kombinácia chemických látok, aby potenciál vznikajúci na elektróde bol čo najväčší, a zároveň aby článok čo najviac vydržal.
Vhodnými a najčastejšími látkami pre zápornú elektródu je zinok, kadmium, lítium a hydrid rôznych kovov, pre kladnú elektródu uhlík (grafit) obklopený burelom (MnO2), nikel a striebro.
Ako elektrolyt sa používa v suchých článkoch a v olovenom akumulátore roztok kyseliny, v alkalických článkoch a v akumulátoroch sa používa roztok zásaditých zlúčenín alkalických kovov.
Prípadné ďalšie látky v elektrochemických článkoch majú za úlohu regulovať chemické reakcie tak, aby sa napríklad predĺžila životnosť článku, znížila možnosť úniku nebezpečných látok a pod.
Spájanie elektrochemických článkov
Na dosiahnutie vyššieho napätia sa články spájajú sériovo do batérií, celkové napätie sa získa ako súčet napätí jednotlivých článkov v batérii. Napríklad plochá batéria obsahuje 3 suché články, 9V batéria obsahuje 6 suchých alebo alkalických článkov, automobilový akumulátor obsahuje 6 akumulátorových článkov.
Pri paralelnom spojení článkov zostáva elektromotorické napätie rovnaké, batéria však znesie vyššie zaťaženie (môže dodávať väčší elektrický prúd). Paralelné spojenie článkov sa používa len zriedkavo, keďže vplyvom malých rozdielov vo vlastnostiach článkov môžu mať články rozdielne napätie, čo má za následok vyrovnávacie prúdy a zníženie kapacity batérie.
Parametre elektrochemických článkov
- druh článku – primárny (je moc slaby ) alebo sekundárny (akumulátor, je moc silny)
- elektromotorické napätie – veľkosť napätia medzi elektródami nezaťaženého článku
- vnútorný odpor – veľkosť odporu článku pri priechode elektrického prúdu
- elektrický výkon – množstvo energie, ktorú je článok schopný dodať za jednotku času, články s veľkým výkonom sa označujú ako tvrdé zdroje, články s malým výkonom sa označujú ako mäkké zdroje
- celková elektrická energia, ktorá sa dá dostať z čerstvého článku až do úplného vybitia (kapacita)
- merná energia – podiel celkovej energie a hmotnosti článku
- hustota energie – podiel celkovej energie na objeme článku
- životnosť článku – doba dodávania energie pri bežnom zaťažení
- nabíjací prúd a nabíjacia doba – pre sekundárne články (akumulátory)
- účinnosť – podiel vydanej a dodanej energie u akumulátorov
- cena – ovplyvnená cenou materiálu (zlato a med je lacnejší, striebro a lítium sú drahšie)
Prehľad elektrochemických článkov
Ue = elektromotorické napätie
em = merná energia (E/m, kde E je elektrická energia, m je hmotnosť)
eV = hustota energie (E/V, kde E je elektrická energia, V je objem)
hodnoty em a ev platia pre čerstvý článok, pri vybíjaní sa znižujú
+ kladná elektróda
− záporná elektróda
elektrolyt – vždy roztok uvedenej látky
| názov článku | elektródy | elektrolyt | Ue [V] | em [kJ/kg] | eV [MJ/m3] | poznámka |
|---|---|---|---|---|---|---|
| primárne články | ||||||
| Voltov článok | +meď Cu −zinok Zn |
kyselina sírová H2SO4 | 1 | ? | ? | historicky prvý zdroj stáleho elektrického prúdu (1800) |
| suchý článok (Leclanchéov článok) |
+burel MnO2 −zinok Zn |
salmiak NH4Cl | 1,5 | 240 | 450 | obyčajná batéria |
| alkalický článok | +burel MnO2 −zinok Zn |
hydroxid draselný KOH | 1,5 | 280 | 900 | kvalitnejšia batéria |
| zinkovo-strieborný článok | +striebro Ag −zinok Zn |
hydroxid draselný KOH | 2,2 | 440 | 1400 | veľmi kvalitná batéria |
| lítiový článok | +burel MnO2 −lítium Li |
hydroxid draselný KOH | 3,1 | ? | 2100 | dlhá životnosť |
| sekundárne články | ||||||
| olovený akumulátor | +oxid olovnatý PbO2 −olovo Pb |
kyselina sírová H2SO4 | 2,2 | 140 | 240 | tvrdý zdroj |
| niklovo-oceľový akumulátor (NiFe) | +nikel Ni −oceľ |
hydroxid draselný KOH | 1,2 | ? | ? | nízka účinnosť |
| niklovo-kadmiový alkalický akumulátor | +nikel Ni −kadmium Cd |
hydroxid draselný KOH | 1,3 | 120 | 350 | obyčajné dobíjacie batérie, jedovaté |
| niklovo-vodíkový alkalický akumulátor | +nikel Ni −vodík MH)* |
hydroxid draselný KOH | 1,3 | 280 | 720 | kvalitné akumulátory, nejedovatý, nemajú pamäťový jav |
Praktické vyhotovenie
Primárne elektrochemické články aj akumulátory sa vyrábajú v rôznych rozmeroch a tvaroch (a v súvislosti s tým v rôznych kapacitách). Niektoré rozmery najmä článkov a batérií používaných v spotrebnej elektronike sú štandardizované napríklad:
- článok AA (= tzv. batéria AA, ceruzková batéria)
- článok AAA (= tzv. batéria AAA, mikroceruzková batéria)
Pozri aj
| Fyzikálny portál Chemický portál |
- Elektrina
- Elektronika
- Elektrický prúd v kvapalinách
- Elektrolýza
- Elektrický zdroj
- Kategória:Elektrické batérie