Alkalický článok
Alkalický článok je elektrochemický článok, čiže chemický zdroj elektrickej energie založený na chemickej reakcii medzi zinkom a uhlíkom za prítomnosti alkalického elektrolytu. Článok má podobný princíp ako suchý článok, ibaže tu reagujú s uhlíkom zinkové piliny, ktorých reakčná plocha je väčšia ako pri zinkovej nádobke, a preto je možné z batérie odoberať väčší prúd.
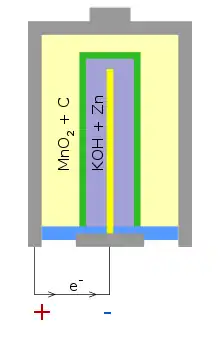
Kladný pól článku sa skladá z oceľovej nádobky (ktorá tvorí aj telo batérie) vyplnená zmesou burelu (MnO2) a uhlíka (C).
Záporný pól je vytvorený rúrkou separátora (obvykle papier), v ktorej je emulzia elektrolytu a práškového zinku (Zn). Ako zberač prúdu pre elektródu sa používa mosadzná tyčka, na ktorú je pripevnený záporný pól článku (batérie).
Elektrolyt je alkalický gél hydroxidu draselného (KOH).
Napätie jedného článku je približne 1,5 V.
Chemické reakcie
- katóda: 2 MnO2 + H2O + 2 e– → Mn2O3 + 2 OH–
- anóda: Zn + 2 OH– → Zn(OH)2 + 2 e–
- výsledná reakcia: 2 MnO2 + H2O + Zn → Mn2O3 + Zn(OH)2
Použitie
Alkalické články majú vyššiu kapacitu a dlhšiu životnosť ako suché články, preto sa používajú ako náhrada za suché články v aplikáciách náročnejších na spotrebu energie a na nárazové odbery (blesk fotoaparátu, digitálny fotoaparát, MP3 prehrávač, hračky). Ich najväčšou výhodou je, že majú veľmi malú samovybíjaciu schopnosť, a preto je z nich možné odoberať malé množstvá prúdu po dlhý čas (náramkové hodinky, zálohovacie batérie). Mylne sa tvrdilo, že alkalické batérie nevytekajú, čo nie je pravdou. Alkalické batérie tiež vytekajú a môžu poškodiť zariadenia, v ktorých sa používajú. Vyrábajú sa v rovnakej rozmerovej škále, ale najväčšie využitie majú v tzv. gombíkových batériách (rozmerov mince a menších).
| Fyzikálny portál Chemický portál |