Trifluoraminoxid
Trifluoraminoxid je anorganická sloučenina a silné fluorační činidlo.
| Trifluoraminoxid | |
|---|---|
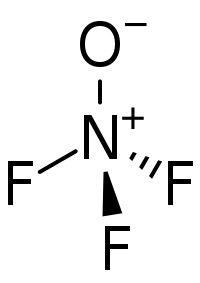
Strukturní vzorec | |
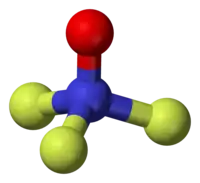
Model molekuly | |
| Obecné | |
| Systematický název | trifluoraminoxid |
| Sumární vzorec | NOF3 |
| Identifikace | |
| Registrační číslo CAS | 13847-65-9 |
| PubChem | 26304 |
| SMILES | [N+]([O-])(F)(F)F |
| InChI | 1S/F3NO/c1-4(2,3)5 |
| Vlastnosti | |
| Molární hmotnost | 87,001 g/mol |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Trifluoraminoxid lze připravit několika způsoby. Jedním z nich je použití elektrického výboje ve směsi kyslíku a fluoridu dusitého. Další možnost, s menší výtěžností, představuje reakce fluoridu ušlechtilého kovu (například IrF6 nebo PtF6) s oxidem dusnatým.[1] Z reakční směsi se odděluje destilací, přečištění lze provést pomoocí roztoku hydroxidu draselného, který reaguje s ostatními vytvořenými sloučeninami obsahujícími fluor.[1]
Jiný způsob přípravy je spálení kyseliny dusičné ve fluoru následované prudkým ochlazením.[2]
Trifluoraminoxid je také možné získat fotochemickou reakcí fluoru s fluoridem nitrosylu:
- F2 + FNO → F3NO.
Tuto reakci lze spustit i zahřátím, ovšem horký fluor může snadno reagovat s použitými nádobami.[3] Existuje i postup založený na tepelném rozkladu hexafluornikelnatanu nitrosylu.[4]
- (NO)2NiF6 + ONF + ONF3
Vlastnosti
F3NO je za standardních podmínek bezbarvý plyn. Jeho kritická teplota je 29,5 °C a kritický tlak přibližně 6,4 MPa.[5]
Trifluoraminoxid má Troutonovu konstantu 20,7.[5] Měrné teplo varu je 16,1 kJ/mol.[5]
Molekula F3NO má C3V symetrii, přičemž jsou všechny vazby N-F stejně dlouhé. Tvar molekuly je téměř tetraedrický, jelikož je vazba N-O podobná vazbám N-F.[1] 19F NMR spektrum obsahuje triplet s chemickým posunem okolo −363 ppm. JNF je 136 Hz.[1] Infračervené spektrum zahrnuje prodloužení vazby N-O při 1 687 cm−1, N-F na 743 cm−1, nesymetrické prodloužení N-F na 887 cm−1 a další pásy na 558, 528, 801, 929, 1 055, 1 410, 1 622, 1 772, 2 435 a 3 345 cm−1.[1] Dipólový moment je 0,0390 D.[6]
Vazba N-O má ze 75 % povahu dvojné vazby, čímž se trifluoraminoxid liší od aminoxidů, kde je amin výrazně zásaditější a na dusíku je kladný náboj.[5] Vazba N-O má délku 115,8 pm a délka vazby N–F činí 143,1 pm; vazebný úhel ∠FNF je 101° a trojice vazebných úhlů ∠ONF má velikost 117°.[7]
Reakce
Při použití trifluoramidoxidu jako fluoračního činidla se vytváří fluorid nitrosylu (NOF).[8] Trifluoraminoxid nereaguje s vodou, sklem ani niklem, díky čemuž se snadno skladuje.[1]
Adukty s pentafluoridy jsou ve skutečnosti hexafluoridpvé soli obsahující ion F2NO+.[1]
| substrát | produkt[8] | poznámky |
|---|---|---|
| N2F4 | NF3 | |
| N2O4 | NO2F | |
| Cl2 | ClF | |
| SF4 | SF6 | |
| H2O | nereaguje | |
| vodný roztok NaOH | NO3−, F− | reaguje pomalu |
| H2SO4 | HNO3,HF | přes F2NO+ |
| SbF5 | SbF5•F3NO | |
| AsF5 | AsF5•F3NO | |
| PF5 | nereaguje | |
| BF3 | BF3•F3NO | |
Trifluoraminoxid pomalu reaguje se rtutí za tvorby fluoridu rtuťného a rtuťnatého a s oxidy dusíku.[5] Při teplotách do 300 °C je poměrně stabilní, ale pomalu se rozkládá na fluor, NO2F, NOF, NO2 a NO. Během rozkladu zůstává kyslík navázán na dusík.[5]
Reference
V tomto článku byl použit překlad textu z článku Trifluoramine oxide na anglické Wikipedii.
- Trifluoramine Oxide. Journal of the American Chemical Society. 1966, s. 2604–2605. DOI 10.1021/ja00963a051.
- P. Powell. The Chemistry of the Non-Metals. [s.l.]: Springer Science & Business Media, 2013. ISBN 9789401169042. S. 134.
- W. B. Fox; J. S. MacKenzie; R. Vitek. The chemistry of trifluoramine oxide. V. Synthesis of F3 no by photochemical fluorination of nitrosyl fluoride. Inorganic and Nuclear Chemistry Letters. 1970, s. 177–179. DOI 10.1016/0020-1650(70)80336-1.
- Neil Bartlett; J. Passmore; E. J. Wells. Nitrogen oxide trifluoride. Chemical Communications (London). 1966, s. 213. DOI 10.1039/C19660000213.
- W. B. Fox; J. S. MacKenzie; E. R. McCarthy; J. R. Holmes; R. Stahl; R. Juurik. Chemistry of trifluoramine oxide. I. Synthesis and characterization of trifluoramine. Inorganic Chemistry. 1968, s. 2064–2067. DOI 10.1021/ic50068a022.
- William H. Kirchhoff; David R. Lide. Microwave Spectrum, Dipole Moment, and Quadrupole Coupling Constant of Trifluoramine Oxide. The Journal of Chemical Physics. 1969, s. 467–468. DOI 10.1063/1.1671761.
- Vernon Plato; William D. Hartford; Kenneth Hedberg. Electron‐Diffraction Investigation of the Molecular Structure of Trifluoramine Oxide, F3NO. The Journal of Chemical Physics. 1970, s. 3488–3494. DOI 10.1063/1.1674522.
- William B. Fox; C. A. Wamser; R. Eibeck; D. K. Huggins; James S. MacKenzie; R. Juurik. Chemistry of trifluoroamine oxide. II. Reactions with inorganic substrates. Inorganic Chemistry. 1969, s. 1247–1249. DOI 10.1021/ic50076a010.