Kritický bod
Kritický bod je bod na fázovém diagramu, který zakončuje křivku vypařování (bod K na obrázku). Tento bod určuje kritický stav látky. Stavové veličiny , a v tomto bodě se nazývají kritický tlak, kritická teplota a kritický objem.

I - pevná fáze
II - kapalná fáze
III - plynná fáze
a - křivka tání
b - křivka sublimace
c - křivka odpařování
T - trojný bod
K - kritický bod
Vlastnosti
V kritickém stavu mizí rozdíl mezi kapalinou a její párou. Při teplotě vyšší než kritická teplota nemůže látka existovat v kapalném skupenství. Plyn, který má teplotu vyšší než je kritická teplota, nelze žádným stlačováním zkapalnit.
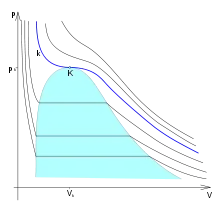
Zobrazením izoterm v p-V diagramu (viz obrázek) je vidět, že v oblasti sycení (označeno barevně) dochází k vypařování kapaliny (popř. kapalnění par). Nad kritickým bodem však již oblast sycení neexistuje a k fázové změně tam tedy nemůže dojít. Izoterma , která prochází kritickým bodem , je kritickou izotermou. Při vyšších teplotách , tzv. nadkritických, již izotermy neprochází oblastí sycení a nelze provést zkapalnění a látka existuje pouze v plynné fázi.