Fluorid arseničný
Fluorid arseničný je chemická sloučenina arsenu a fluoru se vzorcem AsF5.
| Fluorid arsenitý | |
|---|---|
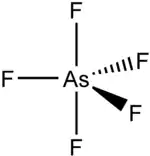
Strukturní vzorec | |
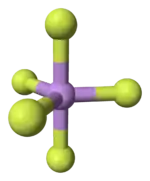
Model molekuly | |
| Obecné | |
| Systematický název | Fluorid arseničný |
| Anglický název | Arsenic pentafluoride (systematický název) Arsenic(V) fluoride Arsorane, pentafluoro- |
| Německý název | Arsen(V)-fluorid |
| Sumární vzorec | AsF5 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7784-36-3 |
| PubChem | 82223 |
| ChEBI | 30530 |
| SMILES | F[As](F)(F)(F)F |
| InChI | 1S/AsF5/c2-1(3,4,5)6 1/AsF5/c2-1(3,4,5)6 |
| Vlastnosti | |
| Molární hmotnost | 169,913 6 g/mol |
| Teplota tání | −79,8 °C |
| Teplota varu | −52,8 °C |
| Hustota | 2,138 g/cm3 |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v benzenu |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R23/25, R50/53 |
| S-věty | S1/2, S20/21, S28, S45, S60, S61 |
| NFPA 704 |  0
4
1
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Fluorid arseničný se vyrábí reakcí arsenu a fluoru v přesném poměru (pokud by bylo méně fluoru, vznikal by také fluorid arsenitý):
2 As + 5 F2 → 2 AsF5.
Lze jej také vyrobit slučováním fluoridu arsenitého s fluorem:
AsF3 + F2 → AsF5.
Vlastnosti a struktura
Za normálních podmínek je AsF5 bezbarvý plyn, jehož molekula má tvar trigonální bipyramidy (dva trojboké jehlany se společnou podstavou).
V pevném skupenství jsou délky osních vazeb (dvě sousední svírají pravý úhel As-F 171,9 pm a délky zbylých dvou vazeb jsou 166,8 pm.
Reakce
Fluorid arseničný vytváří halogenidové komplexy, například s fluoridem siřičitým tvoří iontový komplex[2]:
AsF5 + SF4 → SF3+ + AsF6−.
Bezpečnost
Fluorid arseničný je prudký jed, který nejvíce poškozuje jaterní buňky. Má zřetelný zápach podobný zápachu plynného vinylchloridu.
Podobné sloučeniny
- chlorid arseničný
- fluorid arsenitý
- oxid arseničný
Reference
V tomto článku byl použit překlad textu z článku Arsenic pentafluoride na anglické Wikipedii.
- Arsenic pentafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- An investigation of the structures of the adducts of SF4 with BF3, PF5, AsF5, and SbF5 in the solid state and in solution in HF, M. Azeem, M. Brownstein, and R. J. Gillespie Can. J. Chem. 47(22): 4159–4167 (1969), DOI:10.1139/v69-689
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid arseničný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid arseničný na Wikimedia Commons


