Triethylboran
Triethylboran (zkráceně TEB), také nazývaný triethylbor, je organická sloučenina patřící mezi organoborany, se vzorcem (C2H5)3B, zapisovaným též jako Et3B.
| Triethylboran | |
|---|---|
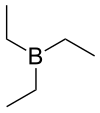
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | triethylboran |
| Ostatní názvy | triethylbor |
| Funkční vzorec | (C2H5)3B |
| Sumární vzorec | C6H15B |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 97-94-9 |
| EC-no (EINECS/ELINCS/NLP) | 202-620-9 |
| PubChem | 7357 |
| SMILES | B(CC)(CC)CC |
| InChI | 1S/C6H15B/c1-4-7(5-2)6-3/h4-6H2,1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 97,993 g/mol |
| Teplota tání | −93 °C (180 K)[1] |
| Teplota varu | 95 °C (368 K)[1] |
| Hustota | 0,70 g/cm3 (23 °C)[1] |
| Index lomu | 1,3971[1] |
| Rozpustnost ve vodě | reaguje[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v ethanolu[1] a tetrahydrofuranu |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v diethyletheru[1] a hexanu |
| Tlak páry | 7,1 kPa[1] |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −194,6 kJ/mol (kapalina) −157,7 kJ/mol (plyn)[1] |
| Měrné teplo | 241,2 J⋅K−1⋅mol−1[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H250 H301 H314 H318 H330 H360}[1] |
| P-věty | P201 P202 P210 P222 P233 P240 P241 P242 P243 P260 P264 P270 P271 P280 P281 P284 P301+310 P301+330+331 P302+334 P303+361+353 P304+340 P305+351+338 P308+313 P310 P320 P321 P330 P363 P370+378 P403+233 P403+235 P405 P422 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava a struktura
Triethylboran se získává reakcí trimethylboritanu s triethylhliníkem:[2]
- Et3Al + (MeO)3B → Et3B + (MeO)3Al
Tato látka se vyskytuje v monomerní formě, čímž se liší od H3B a Et3Al, které vytváří dimery. BC3 jádro molekuly je rovinné.[2]
Použití
V tryskových motorech
Triethylboran se používal k zapalování paliva JP-7[3] a před ním používaného A-12 OXCART v motorech Pratt & Whitney J58 letounů Lockheed SR-71 Blackbird. Triethylboran je pro tento účel vhodný díky své samozápalnosti, obzvláště pak v důsledku vytváření velmi vysokých teplot. U Blackbirdu byl použit, protože palivo JP-7 má velmi nízkou těkavost a je obtížné jej zapálit.
V raketách
Ve směsi s 10 až 15 % triethylhliníku byl TEB použit ke spouštění motorů F-1 u raket Saturn V.[4]
V raketě Falcon 9 společnosti SpaceX se rovněž používá směs triethylhliníku a triethylboranu jako zápalná látka.[5]
V organické chemii
V průmyslu triethylboran slouží jako iniciátor při radikálových reakcích, kde je účinný i za velmi nízkých teplot.[2]
Jako iniciátor může nahradit některé organocínové sloučeniny.
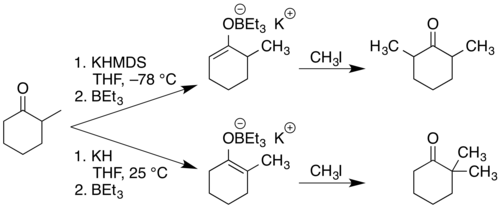
Triethylboran reaguje s enoláty za vzniku enoxytriethylborátů, jež mohou být alkylovány na α-uhlíkových atomech selektivněji než za nepřítomnosti TBE, například enolát vzniklý reakcí cyklohexanonu s hydridem draselným poskytuje za přítomnosti TBE 2-allylcycklohexanon s 90% výtěžností, za jeho nepřítomnosti obsahuje výsledná směs 43 % monoallylovaného produktu, 31 % diallylovaných cyklohexanonů a 28 % nezreagovaného výchozího materiálu.[6] Druh použité zásady i teplota mají vliv na to, jestli vznikne stabilnější či méně stabilní enolát, což umožňuje volit místa, kam se navážou substituenty. Při použití 2-methylcyklohexanonu reagujícího s hydridem draselným a triethylboranem v THF za pokojové teploty vznikne více substituovaný a stabilnější enolát, než reakcí bis(trimethylsilyl)amidu draselného, KN[Si(CH3)3]2, s triethylboranem za −78 °C. První z těchto směsí může reagovat s jodmethanem za vzniku 2,2-dimethylcyklohexanonu s výtěžností 90 %, zatímco ze druhé vzniká 2,6-dimethylcyklohexanon, přičemž výtěžnost činí 93 %.[6][7]
Triethylbor se používá při Bartonových–McCombieových deoxygenacích alkoholů. Ve spojení s tri-terc-butoxyhydridem lithno-hlinitým zde štěpí ethery, například THF se, po hydrolýze, přeměňuje na butan-1-ol. TEB také spouští některé Reformatského reakce.[8]
Triethylboran je také prekurzorem redukčních činidel triethylborohydridu lithného a triethylborohydridu sodného.[9]
- MH + Et3B → MBHEt3 (M = Li, Na)
TEB reaguje s methanolem za tvorby diethyl(methoxy)boranu, který se používá jako chelatační činidlo při Narasakových–Prasadových redukcích, sloužících ke stereoselektivní přípravě syn-1,3-diolů z β-hydroxyketonů.[10][11]
Bezpečnost
Triethylboran je samozápalný, jeho teplota vznícení činí−20 °C.[12] Hoří zeleným plamenem charakteristickým pro sloučeniny boru. Obvykle se tak skladuje i používá za nepřístupu vzduchu. Triethylboran je také toxický při požití, LD50 zjištěná u krys má hodnotu 235 mg/kg.[13]
Odkazy
Související články
- Organoborany
- Pentaboran
Reference
V tomto článku byl použit překlad textu z článku Triethylborane na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/7357
- Robert J. Brotherton; C. Joseph Weber; Clarence R. Guibert; John L. Little. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: Wiley-VCH, 2000-06-15. ISBN 3527306730. DOI 10.1002/14356007.a04_309. Kapitola Boron Compounds.
- Lockheed SR-71 Blackbird [online]. March Field Air Museum [cit. 2009-05-05]. Dostupné v archivu pořízeném z originálu dne 2000-03-04.
- A. Young. The Saturn V F-1 Engine: Powering Apollo Into History. [s.l.]: Springer, 2008. ISBN 978-0-387-09629-2. S. 86.
- Mission Status Center, June 2, 2010, 1905 GMT, SpaceflightNow, accessed 2010-06-02: "The flanges will link the rocket with ground storage tanks containing liquid oxygen, kerosene fuel, helium, gaseous nitrogen and the first stage ignitor source called triethylaluminum-triethylborane, better known as TEA-TEB."
- Handbook of Reagents for Organic Synthesis. Příprava vydání David Crich. [s.l.]: John Wiley & Sons, 2008. ISBN 9780470065365. Kapitola Enoxytriethylborates and Enoxydiethylboranes.
- Ei-ichi Negishi; Sugata Chatterjee. Highly regioselective generation of "thermodynamic" enolates and their direct characterization by NMR. Tetrahedron Letters. 1983, s. 1341–1344. DOI 10.1016/S0040-4039(00)81651-2.
- Yoshinori Yamamoto; Takehiko Yoshimitsu; John L. Wood; Laura Nicole Schacherer. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: Wiley, 2007-03-15. ISBN 978-0471936237. DOI 10.1002/047084289X.rt219.pub3. Kapitola Triethylborane.
- P. Binger; R. Köster. Sodium triethylhydroborate, sodium tetraethylborate, and sodium triethyl-1-propynylborate. Inorganic Syntheses. 1974, s. 136–141. ISBN 9780470132463. DOI 10.1002/9780470132463.ch31.
- Kau-Ming Chen; Karl G. Gunderson; Goetz E. Hardtmann; Kapa Prasad; Oljan Repic; Michael J. Shapiro. A Novel Method for the In situ Generation of Alkoxydialkylboranes and Their Use in the Selective Preparation of 1,3-syn Diols. Chemistry Letters. 1987, s. 1923–1926. DOI 10.1246/cl.1987.1923.
- Yang Jaemoon. Six-Membered Transition States in Organic Synthesis. [s.l.]: John Wiley & Sons, 2008. ISBN 9780470199046. Kapitola Diastereoselective Syn-Reduction of β-Hydroxy Ketones, s. 151–155.
- Fuels and Chemicals - Autoignition Temperatures
- Safety Data Sheet



