Thiokyanatan
Thiokyanatan (též sulfokyanatan, thiokyanid nebo dříve rhodanid) je funkční skupina odvozená od kyseliny thiokyanaté a tvořící sloučeniny iontové založené na [SCN]− a konjugované zásady). Mezi typické sloučeniny patří bezbarvé soli thiokyanatan draselný a sodný. Jako thiokyanatany se označují také organické sloučeniny obsahující funkční skupinu SCN.
Charakteristika
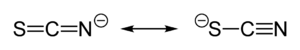
Thiokyanatan je analogem kyanatanu, [OCN]−, kde je kyslík nahrazen sírou. [SCN]− je jedním z pseudohalogenidů, vzhledem k podobnosti reakcí s těmi, které probíhají u halogenidových iontů. Thiokyanatany se dříve označovaly jako rhodanidy (z řeckého slova pro růži), protože komplexy se železem měly červenou barvu. Thiokyanatany vznikají reakcí elementární síry nebo thiosíranů s kyanidy:
- 8 CN− + S8 → 8 SCN−
- CN− + S2O32− → SCN− + SO32−
Druhá z reakcí je katalyzována enzymem sulfotransferázou, která je známa též jako rhodanáza a může mít význam při detoxikaci organismu od kyanidů.
Struktura, vazby a koordinační chemie
U thiokyanatanu sdílí svůj záporný náboj přibližně rovným dílem síra a dusík. V důsledku toho může thiokyanatan působit jako nukleofil, jak na síře, tak na dusíku – je obouvazným ligandem. [SCN]− může být také můstkem pro dva (M−SCN−M) nebo i tři kovové atomy (>SCN− or −SCN<).
Experimentální důkazy vedou k obecnému závěru, že třída kovů A (tvrdé kyseliny) tvoří N-vazné thiokyanatanové komplexy, kdežto třída B (měkké kyseliny) tvoří S-vazné komplexy. Někdy se projevují i jiné faktory, například kinetika a rozpustnost, může se objevit také vazebný izomerismus, například [Co(NH3)5(NCS)]Cl2 a [Co(NH3)5(SCN)]Cl2[1].
Organické thiokyanatany
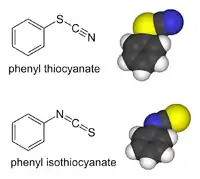
Organické deriváty thiokyanatanů a deriváty s přechodnými kovy mohou existovat jako vazebné izomery. Organická skupina nebo kov se váže na síru: R−S−C≡N má jednoduchou vazbu S-C a trojnou vazbu C-N[2]. V isothiokyanatanech se substituent váže na dusík: R−N=C=S má dvojnou vazbu a C-N taktéž dvojnou vazbu. Organické thiokyanatany se hydrolyzují na thiokarbamáty v Riemschneiderově thiokarbamátové syntéze.
Test na železo Fe3+
Přidá-li se [SCN]− do roztoku obsahujícího železité ionty (Fe3+), zbarví se roztok krvavě červeně, protože se vytvoří ionty [Fe(NCS)(H2O)5]2+.
-3D-balls.png.webp)
Výskyt v těle
Málo pravděpodobný se jeví výskyt rhodanidů v lidských slinách. Zde se totiž mohou rhodanidy tvořit, pokud je osoba kuřákem. U nekuřáků se vyskytne pouze tehdy, pohybuje-li se v zakouřeném prostředí. Už jedna vykouřená cigareta je podnětem pro jejich tvorbu. Jako důkaz může posloužit výše popsaná důkazová reakce. U pravidelných kuřáků vznikne rudý komplex, u občasných kuřáků a nekuřáků s pohybem v zakouřených prostředích vzniká oranžový až jemně červený komplex. Nutno dodat, že tvorba v lidských slinách má jisté antibakteriální účinky, a tedy i protektivní účinky na zuby, neboť tak v důsledku sníženého výskytu bakterií v dutině ústní snižuje riziko tvorby zubního kazu.
Reference
V tomto článku byl použit překlad textu z článku Thiocyanate na anglické Wikipedii.
- Greenwood&Earnshaw p. 326
- Guy, R. G. "Syntheses and Preparative Applications of Thiocyanates" in "Chemistry of Cyanates and Their Derivatives," vol II. Patai, S., (Editor), John Wiley, 1977. New York