Thiokyanatan rtuťnatý
Thiokyanatan rtuťnatý je toxická bílá látka, obsahující rtuťnatý kationt Hg2+ a thiokyanatanový aniont SCN−, se vzorcem Hg(SCN)2. Své využití nalézala v pyrotechnice, dnes se využívá málo kvůli toxicitě.
| Thiokyanatan rtuťnatý | |
|---|---|
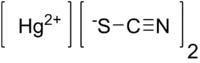
Strukturní vzorec | |
| Obecné | |
| Systematický název | Thiokyanatan rtuťnatý |
| Sumární vzorec | Hg(SCN)2 |
| Vzhled | Pevná bílá látka, jednoklonné krystalky |
| Identifikace | |
| Registrační číslo CAS | 592-85-8 |
| Vlastnosti | |
| Molární hmotnost | 316,79 g/mol |
| Teplota tání | rozklad při 165 °C |
| Hustota | 3,71 g/cm³ |
| Rozpustnost ve vodě | 0,070 g/100 ml (20 °C ) rozpustný ve zředěné kyselině chlorovodíkové |
| Bezpečnost | |
| NFPA 704 |  1
3
1
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Thiokyantan rtuťnatý byl poprvé pravděpodobně vyroben roku 1821 švédským chemikem Jönsem Jacobem Berzeliem. Roku 1866 byl připraven vysoce čistý chemikem Hermesem.
Berzelius přidával oxid rtuťnatý do kyseliny thiokyanaté, za vzniku vody a thiokyanatanu rtuťnatého podle rovnice:
Produkt reakce nebyl moc čistý, jelikož kousky oxidu rtuťnatého se nerozpustily, zreagovaly jen na povrchu a uvnitř zůstaly nezreagované.
Abychom zabránili tomuto efektu, musíme použít ve vodě rozpustné rtuťnaté sloučeniny, např. dusičnan rtuťnatý, octan rtuťnatý či chlorid rtuťnatý. Smícháním dusičnanu rtuťnatého s thiokyanatanem draselným prakticky okamžitě začne vznikat sraženina thiokyanatanu rtuťnatého. Takto byl připraven roku 1866 vysoce čistý:
Tímto způsobem se vyrábí dodnes.
Použití

Thiokyanatan rtuťnatý se používal v pyrotechnice na výrobu faraonových hadů. Granulka této látky se zahřála nad plamenem, a při zahřátí nad 165 °C docházelo k rozpadu podle rovnice:
Směs sulfidu rtuťnatého, oxidu rtuťnatého a oxidu rtuťného vytvářela tvar hada, proto název „faraonovi hadi“. Někteří výrobci přidávali do granulky i malé množství hořlaviny, což umožnilo snadnější zapálení a hoření. Pro svou toxicitu se již ale nepoužívá.

