Thiokyanatan amonný
Thiokyanatan amonný je anorganická sloučenina se vzorcem NH4SCN, sůl amonného kationtu a thiokyanatanového aniontu.
| Thiokyanatan amonný | |
|---|---|
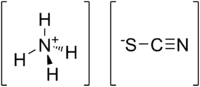
Strukturní vzorec | |
| Obecné | |
| Systematický název | thiokyanatan amonný |
| Funkční vzorec | NH4SCN |
| Sumární vzorec | N2H4SC |
| Vzhled | bezbarvá pevná látka[1] |
| Identifikace | |
| Registrační číslo CAS | 463-56-9 |
| EC-no (EINECS/ELINCS/NLP) | 217-175-6 |
| PubChem | 15666 |
| ChEBI | 30465 |
| SMILES | C(#N)[S-].[NH4+] |
| InChI | 1S/CHNS.H3N/c2-1-3;/h3H;1H3 |
| Vlastnosti | |
| Molární hmotnost | 76,121 g/mol |
| Teplota tání | 149,6 °C (422,8 K)[1] |
| Teplota varu | rozklad[1] |
| Rozpustnost ve vodě | velmi dobře rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech |
velmi dobře rozpustný v kapalném amoniaku, oxidu siřičitém a ethanolu, rozpustný v methanolu a acetonitrilu, nerozpustný v chloroformu a ethylacetátu[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H302 H312 H332 H400 H410 H412[1] |
| P-věty | P261 P264 P270 P271 P273 P280 P301+312 P302+352 P304+312 P304+340 P312 P322 P330 P363 P391 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava a výroba
Thiokyanatan amonný se vyrábí reakcí sirouhlíku s vodným roztokem amoniaku. Meziproduktem je dithiokarbamát amonný, který se zahříváním rozkládá na thiokyanatan amonný a sulfan:
- CS2 + 2 NH3(aq) → NH2C(=S)SNH4 → NH4SCN + H2S
Reakce
Thiokyanatan amonný je na vzduchu stálý; zahříváním se však isomerizuje na thiomočovinu:
Rovnovážná směs obsahuje při 150 °C 30,3 a při 180 °C 25,3 hmotnostních procent thiomočoviny. Zahřátím na 200 °C dojde k rozkladu na amoniak, sulfan, sirouhlík a stopové množství guanidiniumthiokyanátu.
NH4SCN je slabě kyselý; reaguje s hydroxidy alkalických kovů, například sodným nebo draselným, za vzniku thiokyanatanu (sodného nebo draselného), vody a amoniaku. Thiokyanatanový anion reaguje se železitými solemi za vzniku tmavě červeného komplexu:
- 6 SCN− + Fe3+ → [Fe(SCN)6]3−
Thiokyanatan amonný reaguje s ionty několika kovů, například mědi, stříbra, zinku, olova a rtuti, přičemž se sráží příslušné thiokyanatany, které lze extrahovat do organických rozpouštědel.
Použití
Thiokyanatan amonný se používá na výrobu herbicidů, thiomočoviny a průhledných pryskyřic, jako stabilizátor ve fotografii, složka protikorozních přípravků, jako přídavná látka při zpracovávání textilu, k oddělování hafnia od zirkonia a při titračních analýzách.
V roce 1945 bylo navrženo použití thiokyanatanu amonného k omezení úrody rýže v Japonsku v rámci bombardování Japonska.[2]
Thiokyanatan amonný může být také použit ke kolorimetrickému stanovení železa v nápojích.
Dalším možným využitím thiokyanatanu amonného je oddělení chinidinu z likérů po izolaci chininu z neutrálního vodného roztoku síranu. Sůl se přidává k horkému roztoku a vzniklá pevná látka se oddělí od kapaliny a promyje methanolem, který rozpustí většinu nečistot, čímž se vytvoří krystalický thiokyanatan chinidinu o čistotě 90 až 95 %. Následnou separací (obvykle odstřeďováním) lze provést další přečištění do farmaceutické kvality. (Chinidin se používá na léčbu srdeční arytmie.)
Odkazy
Externí odkazy
- A. F. Wells, Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984. ISBN 978-0198553700
Reference
V tomto článku byl použit překlad textu z článku Ammonium thiocyanate na anglické Wikipedii.
- Ammonium thiocyanate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- John David Chappell. Before the Bomb: How America Approached the End of the Pacific War. [s.l.]: University Press of Kentucky, 1997. Dostupné online. ISBN 978-0-8131-7052-7. S. 91–92.


