Picornaviridae
Picornaviridae je čeleď malých neobalených RNA virů, zahrnující několik významných rodů.[1][2] Název čeledi je odvozen od slov pico (velmi malý) a RNA, tedy malé RNA viry.
 Poliovirus | |
| Baltimorova klasifikace virů | |
| Skupina | IV (ssRNA viry s pozitivní polaritou) |
| Vědecká klasifikace | |
| Realm | Riboviria |
| Říše | Orthornavirae |
| Kmen | Pisuviricota |
| Třída | Pisoniviricetes |
| Řád | Picornavirales |
| Čeleď | Picornaviridae |
| Rody | |
| |
| Některá data mohou pocházet z datové položky. | |
Virologie
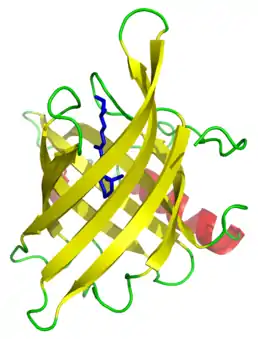
Morfologie
Virion picornavirů se skládá z proteinů VP1, VP2, VP3 a VP4, který je ovšem schován uvnitř kapsidu. Triangulační číslo je proto rovno 3. VP1-3 nemají sekvenční homologii, naproti tomu mají stejnou topologii - osmi vlákenný antiparalelní beta barel (jinak také želé váleček nebo Švýcarský váleček). Tato struktura byla nalezena i v rostlinných virech, což poukazuje na to, že beta barel je jedna z možností, jak dovolit proteinu vytvořit sféru. Pětice proteinů VP1 tvoří pěticípou hvězdici, která je od proteinů VP2 a 3 oddělena prohlubní. Ne všechny picornaviry však tuto prohlubeň mají. Tato prohlubeň je zároveň moc úzká na to, aby vázala protilátky VP1 a VP3 tvoří v kapsidu síť, která je posilněna VP4, a která je esenciální pro stabilitu kapsidu. Stabilita proteinu je také posilněna přítomností zabalené RNA. Další element stabilizující celou strukturu je přítomnost lipidu sfingosinu v hydrofobní kapse kapsidu. Pro rozpad schránky se musí virus tohoto lipidu zbavit, což dokazují experimenty, kdy byl nahrazen lékem WIN, který je v hydrofobní kapse velice stabilní a nemůže být proto odstraněn, což vede k inhibici rozpadu schránky. Některé viry, například rhinoviry, však mají tuto schránku prázdnou. Na glycinu proteinu VP4 je kovalentně vázána kyselina myristová. Po navázání virionu na receptor je tato kyselina vystrčena ven.
Charakteristika
Genom picornavirů je jediná RNA s pozitivní polaritou o délce 7,1-8,9 kb, která je infekční (sama stačí k infikování hostitelské buňky). Je polyadenylovaný, avšak na jeho 5' konci není guaninová čepička. Namísto toho se zde nachází VPg, který je kovalentně spojen s RNA přes tyrosin. Na 5' konci se též nachází dlouhá (624-1199) nepřekládaná oblast, která obsahuje vnitřní ribozomální vstupní místo (IRES). těchto IRES je několik tříd, přičemž I-III je součástí genomu picornavirů. Třída IV je obsažena ve viru žloutenky typu C a V je v genomu Dicistroviridae Tato oblast obsahuje poly(C) sekvence, které jsou u různých druhů různě dlouhé. V případě cardiovirů se jedná o 80 až 250 nukleotidů dlouhý úsek, jehož délka koreluje s infekčností těchto virů. 3' koncová část je dlouhá 47 až 125 bází a rovněž obsahuje sekundární strukturu, v níž je pseudoknot, který zodpovídá za kontrolu RNA syntézy. Genom obsahuje pouze jeden ORF, kterým je translatován jediný dlouhý polypeptid, který je následně sestřižen virálními proteinázami. Tato strategie se vyskytuje u všech picornavirů.
Pokusy s převedením RNA do DNA ukázaly, že tato DNA vyžaduje menší koncentraci než RNA ke spuštění infekce.
Diverzita
Všechny RNA viry se ve svých hostitelích vyskytují v kvazidruzích, což je soubor podobných, ale ne zcela identických druhů. Je to způsobeno absencí kontrolní aktivity RNA polymerázy. Dochází tak zařazení jednoho chybného nukleotidu na 103 až 104 správně zařazených. Viry se tak nacházejí na prahu katastrofální chyby, kdy dojde k vyhlazení celé populace RNA virů. Studie naznačují, že každý nově replikovaný genom se liší dvěma nukleotidy od svého rodičovského. Liší-li se však v 15 nukleotidech (indukováno ribavirinem), sníží se infekčnost o pět řádů. Pokud se ovšem mutační rychlost sníží, mají viry problém s replikací v hostiteli. RNA viry se tedy nalézají mezi Scylou a Charibdou, kdy větší změny v jejich strategii může znamenat absolutní katastrofu.
Dalším způsobem, jak měnit svůj genom je rekombinace. Dochází k ní, je-li buňka napadena viry s dostatečně homologním genomem. Například frekvence rekombinace mezi dvěma genomy Polioviru sérotypu 1 je 100× větší než mezi genomy Polioviru 1 a 2.
Proteom
Proteiny picornavirů jsou translatovány jako jeden dlouhý polyprotein, který je následně autokataliticky rozštěpen proteinázami v tomto polyproteinu. Vznikají tak 3 proteiny, P1, P2 a P3, které jsou nadále štěpeny. Z P1 vznikají postupně V1, V3 a V0, z nějž následně vznikne V2 a V4. Toto štěpení probíhá až v uzavřeném kapsidu, má se tedy za to, že k rozštěpení dochází katalýzou RNA a konzervovaným histidinem v přechodu mezi V2 a V4. Z P2 vznikají proteiny 2A-C a z P3 proteiny 3A-3D.
2A
Protein 2A je nezbytný pro proteolitické štěpení polyproteinu a pro replikaci. Stimuluje syntézu negativního řetězce, ne však pozitivního řetězce. Není známo, jak toho tento protein docílí, je však možné, že proteoliticky upraví buněčný protein, který je nezbytný pro syntézu negativního řetězce. Štěpí eIF4G na eIF4GI a eIF4GII, Pabp a srdeční protein dystrofin. Jde o jeden z induktorů apoptózy.
2B
2B je malý hydrofobní protein nezbytný v prvních krocích syntézy RNA. Bývá nazýván jako viroporin, protože v membránách oligomerizuje a vytváří kanály, jejichž význam však dosud není objasněn. Inhibuje však sekreci proteinů v Golgiho aparátu a permeabilizuje membránu, což může hrát roli v uvolnění viru z buňky. Je také částečně zodpovědný za zvesikulování membrán, kde dochází k replikaci virů. Stejný efekt má však i protein 3A. Jde o jeden z inhibitorů apoptózy.
2C
Tento protein má silně konzervovaná místa pro navázání membrány, RNA a NTP, což naznačuje, že se skládá ze tří domén, kdy na N a C konci jsou alifatické alfa-helixy, které interagují s membránou a střední doménu vázající NTP. Izolace mutantů rezistentních vůči guanidin hydrochloridu, který blokuje virovou replikaci zabráněním iniciace syntézy negativního řetězce (nemá však vliv na iniciaci syntézy pozitivního řetězce nebo elongaci obou) inhibicí NTPázové aktivity ukázaly, že je za tuto rezistenci zodpovědný právě protein 2C. 2C má sekvenční homologii se známými helikázami, v čisté formě však tuto funkci nemá. Syntéza tohoto proteinu má za následek rozpad Golgiho aparátu a endoplasmatického retikula, čímž se zformují váčky, které jsou však nepodobné těm, na kterých probíhá virální replikace. Jde o jeden z induktorů apoptózy.
2BC
Většina 2BC, který je prekurzor 2B a 2C, zůstává během infekce nesestřižen, přičemž jeho přítomnost je nezbytná pro replikaci. Syntéza 2BC způsobí zvýšení permeability membrány mnohem více než přítomnost 2B, což vede k vytvoření vesikulů podobnějším těm replikačním více, než jaké vytváří 2C.
3A
Silně hydrofobní část C konce proteinu 3A zaručuje jak jemu, tak jeho prekurzoru 3AB asociaci s membránou. Změny v záběru hostitelů jsou vysvětleny změnami v 3A. 3A je homodimer, jehož potřeba dimerizovat není plně vysvětlena. Jde o jeden z inhibitorů apoptózy.
3B
Protein 3B, také známý jako VPg (viral protein, genus linked), slouží jako proteinový primer kovalentně spojený s polyU počátkem RNA přes tyrozin. Má délku 22-24 aminokyselin, zmíněný tyrozin je ale vždy 3 od N konce. Není důležitý pro infekčnost RNA, je však esenciální pro replikaci.
3AB
Tento protein slouží jako kotva v membráně pro první krok replikace. Čistý protein zesiluje účinky proteinu 3D, replikázy. Mutace v 3D v místech, kde dochází k interakci s 3AB naruší syntézu RNA. Komplex 3AB a 3CD se váže na 3'-terminální sekvenci RNA polioviru.
3C
Protein 3C je proteináza , která se sama vyštípe z P3, následně vyštěpuje další proteiny z polyproteinu. Její další funkcí je rozštěpení TFIID, TFIIC, TFIIIC, SL-1 (selectivity factor) a UBF (upstream binding factor) čímž dojde k inhibici transkripce všech tří eukaryotických polymeráz. k tomu však dochází v jádře buňky. 3C musí být pro svoji absenci NLS (jaderný lokalizační signál) do jádra přenesen společně s 3D, který tuto sekvenci má, v prekurzoru 3CD. Jde o jeden z induktorů apoptózy.
3D
Jedná se o RNA dependentní RNA polymerázu, která zahájí svoji aktivitu po rozštěpení prekurzoru 3CD. Jako většina takovýchto polymeráz, postrádá opravnou funkci, což vysvětluje obrovskou variabilitu RNA virů. Její sekvence je analogická ostatním polymerázám, ale pro svoji aktivitu vyžaduje EF-Tu, EF-Ts a ribozomální protein S1.
Receptory a koreceptory
Pro vstup do buněk slouží picornavirům IG-like receptory, jako CD55, jinak také známý jako PVR (poliovirus receptor) nebo ICAM-1 v případě rhinovirů. CD55 je zároveň s CD226 a CD96 součástí receptorů rozeznávaných NK-buňkami a slouží i jako receptor pro alphaherpesvirinae. Naproti tomu CD44 není virový receptor, ale protilátky vázající se na CD44 způsobí, že dojde ke stérickému zabránění polioviru na blízký CD55.
Některé viry vyžadují přítomnost koreceptorů. Například coxsackievir A21 vyžadují přítomnost jak CD55, tak ICAM-1. Role koreceptorů se dá vysvětlit na coxsackieviru B, který napadá polarizované epiteliální buňky skrze CAR (coxsackievirus and adenovirus receptor), který je však součástí těsných spojů buňky. Naváže se proto na CD55, čímž aktivuje Abl kinázu, která vede k Rac-dependentní aktinovému přeuspořádání, což vede k přesunu viru do těsných spojů, kde se naváže na CAR.
Jelikož RNA viry vytváří velké množství mutantů, mnohokrát pasážované druhy mohou za jistých podmínek vyměnit afinitu k jednomu receptoru za druhý, přičemž ztrácejí schopnost vázat původní.
Vstup do buňky
Po navázání na receptor dojde k řadě konformačních změn. Jedna z hypotéz vysvětluje vznik takzvané A částice. N konce VP1, které jsou normálně přítomny uvnitř kapsidu jsou vystrčeny do hostitelské membrány, přičemž pentamer VP1 vytvoří pór pro RNA, která tak může vniknout do buňky. Není známo, zda virus proniká plasmatickou membránou, nebo endozomem, protože látky blokující transport protonů do váčků nezpomalují replikaci na rozdíl od virů chřipky či Semliki Forest virus, stejně jako inhibice tvoření klatrinových váčků (výjimka je rhinovirus 16).
Například FMDV je však vybaven na vstup do buňky endozomální cestou. Navázání nenavozuje konformační změnu, avšak pentamer VP1 je obklopen histidinovými zbytky, jejichž pKa je 6,8. Když pH v endozomech klesna na 6,5, dojde z rozpadu kapsidu a vypuštění RNA.
Translace
Po vstupu viru do buňky dojde k odštěpení VPg buněčným odpojovacím enzymem. Poté se IRES naváže na 40S ribozomální podjednotku buďto přímo, anebo za pomocí buněčných komponent. Patří mezi ně eIF3, eIF4A, eIF4E a eIF4G. Po translaci 2A, který má proteázovou aktivitu je rozštěpen eIF4G s navázaným eIF4E, čímž dojde k zastavení translace buněčné mRNA, která vyžaduje oba tyto faktory díky jejich schopnosti rozeznat čepičku a vytvořit s ní iniciační komplex. Translace buněčné mRNA se snižuje, zatímco translace virové RNA se zvyšuje. Po vystřižení 3C z polyproteinu je zastavena i buněčná transkripce. Genomy některých virů obsahují vedoucí L sekvenci, která kóduje L protein, který má proteázovou aktivitu.
V průběhu infekce je zničen jako Golgiho aparát, tak endoplasmatické retikulum, aby byly vytvořeny váčky, na kterých probíhá replikace.
Replikace a translace na jednom vlákně nemůže probíhat souběžně. Zůstává však záhadou, jaký kontrolní mechanismus přepíná mezi translací a replikací. Nejnovější poznatky poukazují na hlavní úlohu replikázy. Někdy ovšem dojde ke kolizi, jak je doloženo díky mutantům, kteří ve svém genomu obsahují nukleotidů rRNA. při replikaci přeskočila replikáza na ribozom, kde část rRNA zkopírovala a poté přeskočila zpátky na templát.
Změny hostitelské buňky
jak bylo zmíněno dříve, dochází ke štěpení eIF4G. není to však jediná cesta, jak vyřadit translaci buněčné mRNA. Další způsob je defosforylace 4E-BP1, kdy tento protein projde konformační změnou dovolujícímu navázat se na eIF4E, čímž se mu zabrání v navázání na eIF4G. Po opětovné fosforylaci 4E-BP1 dojde ke zpětné konformační změně a eIF4F je opět uvolněn.
Dochází též k inhibici transportu proteinů do jádra. Při infekci je řada jaderných proteinů potřebných v cytoplasmě, a proto je potřeba tento dopravní systém vyřadit z činnosti.
Proteiny 2B, 2BC blokují Golgiho aparát a 3A blokuje ER, čímž kompletně blokují sekretorické dráhy, čímž se zabrání sekreci cytokinů a MHC.
Buňka po infekci začne projevovat známky cytopathického efektu. V mnoha případech je velmi podobný apoptóze (shromažďování chromatinu, změny permeability membrán, vysychání buňky atd.).
Odkazy
Reference
- GORBALENYA, Alexander E.; ZELL, Roland, et al. (ICTV). Picornaviridae (in the 10th ICTV Report on Virus Classification and Taxon Nomenclature) [online]. Říjen 2017, rev. září 2020 [cit. 2022-03-14]. Dostupné online. (anglicky)
- ZELL, Roland, et al. ICTV Virus Taxonomy Profile: Picornaviridae. S. 2421–2422. Journal of General Virology [online]. Microbiology Society, 2017-10-01 [cit. 2022-03-14]. Roč. 98, čís. 10, s. 2421–2422. Dostupné online. ISSN 1465-2099. DOI 10.1099/jgv.0.000911. (anglicky)
Literatura
- Fields Virology 5th Edition
Externí odkazy
 Obrázky, zvuky či videa k tématu Picornaviridae na Wikimedia Commons
Obrázky, zvuky či videa k tématu Picornaviridae na Wikimedia Commons