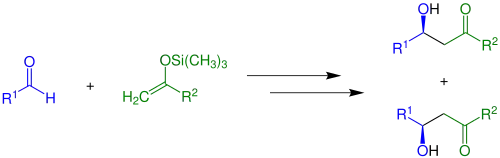Mukaijamova aldolová adice
Mukaijamova aldolová adice je organická reakce, druh aldolové reakce mezi silylenoletherem a aldehydem nebo mravenčanem.[1] Reakci objevil Teruaki Mukaijama roku 1973.[2] Jeho volba reaktantů umožňuje překříženou aldolovou reakci aldehydu s ketonem nebo s jiným aldehydem bez samokondenzace aldehydu a je proto často používána v organické syntéze.
Obecné schéma reakce
Mukaijamova aldolová adice je adice enolsilanů na karbonylové sloučeniny řízená Lewisovou kyselinou. Lze při ní použít sloučeniny s různými organickými skupinami.[3] Na následujícím obrázku je znázorněna zásaditá verze (R2 = H) bez přítomnosti chirálních katalyzátorů:
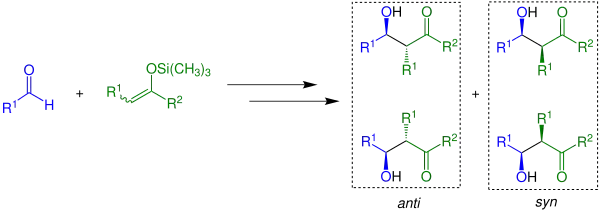
Vzniká racemická směs enantiomerů. Pokud jsou použity Z- nebo E-enolsilany, vzniká směs čtyř produktů, která obsahuje dva racemáty:
Typickou reakcí tohoto typu je reakce silylenoletheru cyklohexanonu s benzaldehydem. Při pokojové teplotě poskytuje směs threo (63 %) a erythro (19 %) β-hydroxyketonu a exocyklického enonu. V původní reakci byla Lewisova kyselina (zde chlorid titaničitý) použita ve stechiometrickém množství, ovšem existuje i čistě katalytický systém. Reakce je také optimalizována pro asymetrické syntézy.
Mechanismus
Níže je zobrazen reakční mechanismus pro R2 = H:
V této reakci je jako Lewisova kyselina použit chlorid titaničitý (TiCl4). Nejprve Lewisova kyselina aktivuje aldehydovou skupinu, poté následuje tvorba vazby uhlík-uhlík mezi enolsilanem a aktivovaným aldehydem. Následným odštěpením chlorsilanu vzniká produkt 1. Požadovaný produkt, racemická směs látek 2 a 3, se získá jeho reakcí s vodou.
Příklady
Typickou reakcí mezi dvěma ketony je reakce acetofenonu jako enolu s acetonem:[4]
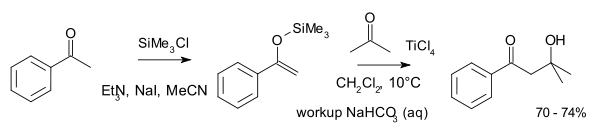
Ketonové reakce tohoto typu probíhají za vyšších teplot.
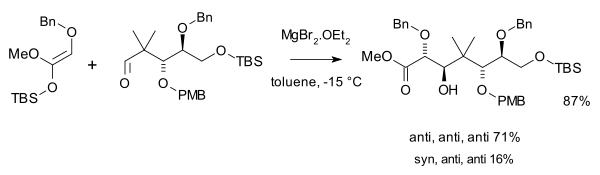
Mukaijama použil pro syntézu taxolu dvě aldolové adice[5][6], jednu z nich s ketensilylacetalem a přebytkem bromidu hořečnatého:
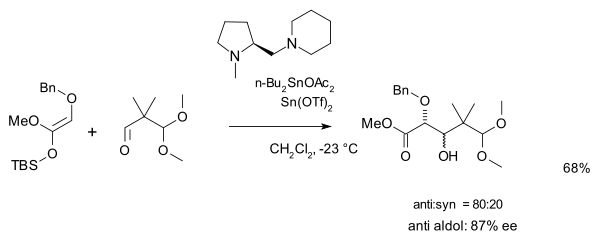
a druhou s aminovým chirálním ligandem a triflátovým katalyzátorem:
Využívání komplexů chirálních Lewisových kyselin a Lewisových zásad v asymetrickém katalytickém procesu je nejrychleji se rozvíjející oblastí použití Mukaijamovy aldolové reakce.[3]
Reference
V tomto článku byl použit překlad textu z článku Mukaiyama aldol addition na anglické Wikipedii.
- Mukaiyama, T.; Kobayashi, S. Org. React. 1994, 46, 1.
- New aldol type reaction Teruaki Mukaiyama, Koichi Narasaka and Kazuo Banno Chemistry Letters Vol.2 (1973) , No.9 pp.1011–1014
- László Kürti und Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 298–299, ISBN 978-0-12-429785-2.
- Organic Syntheses, Coll. Vol. 8, p.323 (1993); Vol. 65, p. 6 (1987). http://www.orgsynth.org/orgsyn/pdfs/CV8P0323.pdf
- Asymmetric Total Synthesis of Taxol Teruaki Mukaiyama , Isamu Shiina, Hayato Iwadare, Masahiro Saitoh, Toshihiro Nishimura, Naoto Ohkawa, Hiroki Sakoh, Koji Nishimura, Yu-ichirou Tani, Masatoshi Hasegawa, Koji Yamada , Katsuyuki Saitoh Chem. Eur. J. 1999, 5, No. 1
- TBS = t-butyldimethylsilyl, Bn = benzyl, PMB = p-methoxybenzylether