Methylentrifenylfosforan
Methylentrifenylfosforan je derivát fosforanu se vzorcem (C6H5)3PCH2. Jsou od ní odvozeny fosforečné ylidy známé jako Wittigova činidla. Jedná se o značně polární silnou zásadu.
| Methylentrifenylfosforan | |
|---|---|
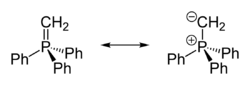
Rezonanční struktury methylentrifenylfosforanu | |

Model molekuly | |
| Obecné | |
| Systematický název | methyliden(trifenyl)-λ5-fosfan |
| Ostatní názvy | methylen(trifenyl)fosforan |
| Sumární vzorec | C19H17P |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 3487-44-3 |
| PubChem | 137960 |
| SMILES | C=P(C1=CC=CC=C1)(C2=CC=CC=C2)C3=CC=CC=C3 |
| InChI | 1/C19H17P/c1-20(17-11-5-2-6-12-17,18-13-7-3-8-14-18)19-15-9-4-10-16-19/h2-16H,1H2 |
| Vlastnosti | |
| Molární hmotnost | 276,31 g/mol |
| Hustota | 1,19 g/cm3 |
| Rozpustnost ve vodě | rozkládá se |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v tetrahydrofuranu |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava a použití
Methylentrifenylfosforan se připravuje deprotonací methyltrifenylfosfoniumbromidu pomocí silné zásady jako je například butyllithium:[1]
Tato látka se používá na nahrazování kyslíkových atomů v aldehydech a ketonech methylenovými skupinami:
- R2CO + (C6H5)3PCH2 → R2C=CH2 + (C6H5)3PO
Jedním z produktů je také trifenylfosfinoxid.
Struktura
Krystalograficky bylo zjištěno, že molekula methylentrifenylfosforanu má přibližně čtyřstěnný tvar. PCH2 centrum je rovinné, délka vazby P=CH2 je 166,1 pm, vazby mezi fosforem a fenylovými skupinami mají délku 182,3 pm.[2] Sloučenina vytváří dvě rezonanční struktury:
- (C6H5)3P+CH2− ↔ (C6H5)3P=CH2
2.png.webp)
Podobné sloučeniny
Skupiny odtahující elektrony usnadňují deprotonaci fosfoniových solí. Toto je možné ukázat na trifenylkarbethoxymethylovém kationtu, odvozeném od trifenylfosfinu a esterů kyseliny chloroctové, k jehož deprotonaci stačí hydroxid sodný. Vzniklý trifenylkarbethoxymethylenfosforan je na vzduchu poměrně stabilní, je však méně reaktivní než ylidy neobsahující skupiny odtahující elektrony. Často nereaguje s ketony, a je tak třeba místo toho použít Hornerovu–Wadsworthovu–Emmonsovu reakci. Z takto stabilizovaných ylidů se často tvoří E-alkeny namísto jinak běžnějších Z-alkenů.

I když mají tyto ylidy vysokou elektronovou hustotu, tak mohou být deprotonovány. Reakcí (CH3)3PCH2 s butyllithiem vzniká (CH3)2P(CH2)2Li.[4]
Lithiované ylidy mají vlastnosti podobné karboaniontům, a tak mohou fungovat jako ligandy. (CH2)2P(CH2)2Li je bidentátním ligandem.
Reference
V tomto článku byl použit překlad textu z článku Methylenetriphenylphosphorane na anglické Wikipedii.
- Georg Wittig; U. Schoellkopf. Methylenecyclohexane. Organic Syntheses. 1960, s. 66. DOI 10.15227/orgsyn.040.0066.
- J. C. J. Bart. Structure of the non-stabilized phosphonium ylid methylenetriphenylphosphorane. Journal of the Chemical Society B. 1969, s. 350–365. DOI 10.1039/J29690000350.
- Ralf Tonner; Florian Oexler; Bernhard Neumueller; Wolfgang Petz; Gernot Frenking. Carbodiphosphoranes: The Chemistry of Divalent Carbon(0). Angewandte Chemie International Edition. 2006, s. 8038–8042. DOI 10.1002/anie.200602552. PMID 17075933.
- J. P. Fackler; J. D. Basil. Oxidative Addition of Methyl Iodide to a Dinuclear gold(I) Complex. The X-Ray Crystal Structure of Bis[mu-(Dimethyldimethylenephosphoranyl-C,C)]-iodomethyldigold(II)(Au-Au), Au2[(CH2)2P(CH3)2]2(CH3). Organometallics. 1982, s. 871–873. DOI 10.1021/om00066a021.
- H. Schmidbaur. Phosphorus Ylides in the Coordination Sphere of Transition Metals: An Inventory. Angewandte Chemie International Edition in English. 1983, s. 907–927. DOI 10.1002/anie.198309071.