Membrány asociované s mitochondriemi
Kontaktní místa mitochondrie - endoplazmatické retikulum (MERCS; angl. Mitochondria and Endoplasmic Reticulum Contact Sites) jsou oblasti mezi mitochondriemi a endoplazmatickým retikulem, kde membrány obou organel leží paralelně blízko sebe (10–90 nm). Vzájemná blízkost tak umožňuje komunikaci a výměnu látek mezi oběma organelami. Šířka a délka těchto kontaktů jsou pak zásadními parametry mající vliv na jejich biologické funkce. Kontaktní místa zásadně ovlivňují některé buněčné události a procesy, jako např. homeostázu vápníku [1], metabolismus a import lipidů z ER do mitochondrií [2], mitochondriální dělení [3], autofagii [4] či apoptózu [5]. Pro vykonávání a regulaci těchto procesů musí být kontaktní místa vysoce dynamická a reagovat na potřeby a metabolický stav buňky. Hrají také roli při rozvoji neurodegenerativních onemocnění a regulaci homeostázy glukózy.
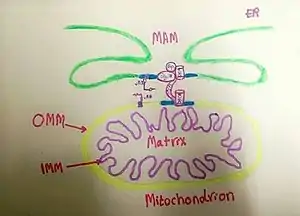
V literatuře se často používá i alternativní pojmenování - membrány asociované s mitochondriemi (MAMs; angl. Mitochondria-Associated Membranes), což odkazuje na způsob jejich izolace. MAMs jsou totiž získávány jako jedna z frakcí subcelulární frakcionace buněk, která obsahuje oblasti ER připojené k vnější mitochondriální membráně (bez kontaminace jinými organelami). Ač jsou oba termíny často chápany jako synonyma, nemají tedy (v přísném pohledu) zcela ekvivalentní význam: MERCS popisuje spíše vlastní kontakt mezi mitochondrií a ER, zatímco MAMs odkazují spíše na "výsledek" biochemické separace.[6]
Funkce
Homeostáza vápníku
Membrány asociované s mitochondriemi se podílejí na transportu vápníku z ER do mitochondrií. Tato interakce je důležitá pro rychlé vychytávání vápníku mitochondriemi prostřednictvím aniontových kanálů závislých na napětí (VDAC), které jsou umístěny na vnější mitochondriální membráně (OMM). Tento transport je regulován chaperony a regulačními proteiny, které řídí tvorbu ER-mitochondriálního spojení. Přenos vápníku z ER do mitochondrií závisí na vysoké koncentraci vápníku v mezimembránovém prostoru a mitochondriální kalciový uniporter (MCU) akumuluje vápník do mitochondriální matrice pro elektrochemický gradient.
Regulace metabolismu lipidů
Transport fosfatidylserinu do mitochondrií z ER k dekarboxylaci na fosfatidylethanolamin přes ER-mitochondriální lipid, který transformuje kyselinu fosfatidovou (PA) na fosfatidylserin (PS) pomocí fosfatidylserinsyntáz 1 a 2 (PSS1, PSS2) v ER a poté přenáší do mitochondrií, kde se fosfatidylserindekarboxyláza (PSD) transformuje na fosfatidylethanolamin (PE). PE, který je syntetizován v mitochondriích, se vrací do ER, kde fosfatidylethanolamin methyltransferáza 2 (PEMT2) syntetizuje PC (fosfatidylcholin).
Regulace autofagie a mitofágie
Tvorba autofagozomů prostřednictvím koordinace proteinů ATG (souvisejících s autofagií) a vezikulárního přenosu pomocí MAM.
Dynamika a funkce mitochondrií a přežití buněk
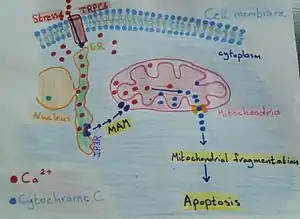
Kontaktní místa byla spojována s jemnou rovnováhou mezi životem a smrtí buňky. Izolační membrány jsou počátečním krokem k vytvoření autofagozomů. Tyto uzavřené membrány jsou dvojité membránové vazby a uvnitř jsou lysozomy. Hlavní funkcí těchto membrán je degradace jako role v buněčné homeostáze. Jejich původ však zůstal nejasný. Možná je to plazmatická membrána, endoplazmatické retikulum (ER) a mitochondrie. Ale kontaktní místo ER-mitochondrie má markery, marker autofagozomu ATG14 a marker tvorby autofagozomu ATG5, dokud není tvorba autofagozomu dokončena. Vzhledem k tomu, že absence ATG14 puncta je způsobena rozpadem kontaktního místa ER-mitochondrie. Oxidační stres a počátek stresu endoplazmatického retikula (ER) se vyskytují společně; stres ER má klíčový senzor obohacený o membrány ER spojené s mitochondriemi (MAM). Tímto klíčem je PERK (RNA-dependentní protein kináza (PKR)-like ER kinase), PERK přispívá k apoptóze dvojnásobně tím, že udržuje hladiny proapoptotického C/EBP homologního proteinu (CHOP). Těsné kontaktní místo ER-mitochondrie je nedílnou součástí mechanismů kontrolujících buněčnou apoptózu a meziorganelových signálů skrze vápník. Membrány ER spojené s mitochondriemi (MAM) hrají roli v modulaci buněčné smrti. Permeabilizace zevní membrány mitochondrií (MOMP) je příčinou vyšších hladin vápníku v matrici, která působí jako spouštěč apoptózy. MOMP je proces před apoptózou, který je doprovázen permeabilitou vnitřní membrány mitochondrií (IMM). Otevření pórů přechodu permeability (PTP) vyvolává otok mitochondrií a prasknutí vnější membrány mitochondrií (OMM). Navíc otevření PTP indukuje uvolnění kaspázových aktivačních faktorů a apoptózu. Faktory aktivující kaspázu indukované cytochromem C k navázání na IP3R, bude to mít za následek vyšší přenos vápníku z ER do mitochondrií, čímž se zesílí apoptotický signál.
Poruchy a onemocnění
Alzheimerova choroba
Membrány asociované s mitochondriemi hrají důležitou roli v homeostáze vápníku, metabolismu fosfolipidů a cholesterolu. Díky tomu jsou spojovány změny těchto funkcí u Alzheimerovy choroby. U mitochondriálních membrán pacientů s Alzheimerovou chorobou bylo popsáno, že mají upregulaci lipidů syntetizovaných v MAM vedle sebe a upregulaci proteinových komplexů přítomných v kontaktní oblasti mezi ER a mitochondriemi. Výzkum naznačil, že místa MAM jsou primárními místy aktivity pro aktivitu y-sekretázy (uplatňuje se při štěpení beta-APP proteinu) a lokalizaci amyloidního prekurzorového proteinu (APP) spolu s proteiny presenilin 1 (PS1), presenilin 2 (PS2). Pacienti s diagnózou Alzheimerovy choroby předložili výsledky, které naznačovaly akumulaci amyloidního beta peptidu v mozku, což zase vede k návrhu amyloidní kaskády. Zvýšená konektivita mezi ER a mitochondriemi v místech MAM byla také pozorována u lidských pacientů s diagnostikovanou familiární AD (FAD) zvýšením počtu kontaktních míst. Tito jedinci vykazovali mutace v proteinech PS1, PS2 a APP v místech MAM. Tato zvýšená konektivita také způsobila abnormalitu v signalizaci Ca+2 mezi neurony. Také s ohledem na roli v MAM v metabolismu fosfolipidů bylo hlášeno, že pacienti s diagnózou AD vykazují změny v hladinách fosfatedylserinu a fosfatedylethanolaminu v ER a mitochondriích, což vede k intracelulárním klubkům obsahujícím hyperfosforylované formy proteinu asociovaného s mikrotubuly tau v tkáních.
Parkinsonova nemoc
Jednou z příčin Parkinsonovy choroby jsou mutace v genech kódujících různé proteiny, které jsou lokalizovány v místech MAM. Mutace v genech, které kódují proteiny Parkin, PINK1, alfa-Synuclein (α-Syn) nebo protein deglykáza DJ-1, byly prostřednictvím výzkumu spojeny s tímto onemocněním. Stále se však zvažuje další výzkum s cílem určit přímé korelace těchto genů s Parkinsonovou nemocí. Za normálních podmínek se předpokládá, že tyto geny jsou zodpovědné za schopnost buněk degradovat mitochondrie, které se staly nefunkčními v procesu známém jako mitofágie . Mutace v genech Parkin a pink1 však byly spojeny s tím, že se buňky stávají neschopnými degradovat vadné mitochondrie. Bylo prokázáno, že proteiny alfa-synuclein (a-Syn) a DJ-1 podporují interakci funkce MAM mezi ER a mitochondriemi. Gen divokého typu, který kóduje a-Syn, podporuje fyzické spojení mezi ER a mitochondriemi vazbou na oblasti lipidového raftu MAM. Mutovaná forma tohoto genu má však nízkou afinitu k oblastem lipidového raftu, čímž snižuje kontakt mezi ER a mitochondriemi a způsobuje akumulaci a-Syn v Lewyho tělíscích, což je hlavní charakteristika PD. Další výzkum asociace PD se změnami v MAM se stále vyvíjí.
Související články
- Mitochondrie
- Neurodegenerace
- Alzheimerova choroba
- Parkinsonova choroba
Reference
V tomto článku byl použit překlad textu z článku Mitochondria associated membranes na anglické Wikipedii.
- CSORDÁS, G.; HAJNÓCZKY, G. Sorting of calcium signals at the junctions of endoplasmic reticulum and mitochondria. Cell Calcium. 2001-04, roč. 29, čís. 4, s. 249–262. Dostupné online [cit. 2022-01-13]. ISSN 0143-4160. DOI 10.1054/ceca.2000.0191.
- RUSIÑOL, A E; CUI, Z; CHEN, M H. A unique mitochondria-associated membrane fraction from rat liver has a high capacity for lipid synthesis and contains pre-Golgi secretory proteins including nascent lipoproteins.. Journal of Biological Chemistry. 1994-11, roč. 269, čís. 44, s. 27494–27502. Dostupné online [cit. 2022-01-13]. ISSN 0021-9258. DOI 10.1016/s0021-9258(18)47012-3.
- ROBIN., Friedman, Jonathan. The mechanism and function of ER dynamics.. [s.l.]: [s.n.] Dostupné online. ISBN 978-1-267-33532-6, ISBN 1-267-33532-7. OCLC 874093806
- HAMASAKI, Maho; FURUTA, Nobumichi; MATSUDA, Atsushi. Autophagosomes form at ER–mitochondria contact sites. Nature. 2013-03, roč. 495, čís. 7441, s. 389–393. Dostupné online [cit. 2022-01-13]. ISSN 0028-0836. DOI 10.1038/nature11910. (anglicky)
- IWASAWA, Ryota; MAHUL-MELLIER, Anne-Laure; DATLER, Christoph. Fis1 and Bap31 bridge the mitochondria-ER interface to establish a platform for apoptosis induction. The EMBO Journal. 2010-12-24, roč. 30, čís. 3, s. 556–568. Dostupné online [cit. 2022-01-13]. ISSN 0261-4189. DOI 10.1038/emboj.2010.346.
- GIACOMELLO, M; PELLEGRINI, L. The coming of age of the mitochondria–ER contact: a matter of thickness. Cell Death & Differentiation. 2016-06-24, roč. 23, čís. 9, s. 1417–1427. Dostupné online [cit. 2022-01-21]. ISSN 1350-9047. DOI 10.1038/cdd.2016.52.