Makrofág
Makrofág je buňka přirozené imunity, která hraje velmi důležitou roli v imunitní reakci. Jedná se o zástupce mononukleárů, tj. buněk s jedním, nesegmentovaným jádrem.

Vývoj
Makrofág vzniká přeměnou z monocytů. Ty jsou tvořeny v kostní dřeni z kmenové hemopoetické buňky a jsou vyplavovány do krevního oběhu. Monocyty kolují v krvi asi 8 hodin, poté vstupují do tkání a tam se mění na makrofágy. Tkáňové makrofágy pak vykazují četnou heterogenitu v závislosti na tkáni. Mezi tkáňové makrofágy patří Kupfferovy buňky, histiocyty, osteoklasty či mikroglie.
Přeměna monocytu na makrofág
Aby se monocyt přeměnil na makrofág, musí proběhnout několik kroků. Zvětšuje se velikost buňky, zvyšuje se počet lysozomů, receptorů pro imunoglobulin IgG a zvyšuje se jeho schopnost fagocytózy.
Polarizace makrofágů
Stejně jako u většiny buněk imunitního systému, vývoj a funkce makrofágů závisí na cytokinovém prostředí, ve kterém se nachází. Již od devadesátých let dvacátého století je známo, že působení jednotlivých cytokinů na genovou expresi v těchto buňkách je odlišné (porovnával se např. vliv IL-4 a IFNγ). Později přichází nová klasifikace makrofágů a rozdělení na M1 a M2 obdobně, jak tomu je u T lymfocytů. Tato klasifikace byla odvozena na základě lišícího se metabolizmu argininu v buňkách. V makrofázích ovlivněných cytokinovým prostředím, které vzniklo působením Th1 T lymfocytů (IFNγ), docházelo ke tvorbě oxidu dusnatého (NO), kdyžto v populaci makrofágů z prostředí Th2 (IL-4, TGF-β) docházelo ke konverzi argininu na ornitin (prostřednictvím enzymu argináza).[1] M1 tudíž můžeme považovat za klasicky aktivované makrofágy s prozánětlivou funkcí, kdyžto M2 za alternativně aktivované s funkcí protizánětlivou. M2 skupinu makrofágů můžeme dále dělit na M2a, M2b, M2c a M2d v závislosti na konkrétním stimulu. Takto hrubé dělení je nutno brát s nadhledem a jako hodně zjednodušené. Existuje celé spektrum populací makrofágů, např. makrofágy asociované s nádorem (tumor associated macrophages, TAMs), makrofágy exprimující TCR receptor a CD169, aj. [1][2]
M1 makrofágy
Zánětlivé cytokinové prostředí (hlavně IFNγ) vytvořené efektorovými T lymfocyty a rozeznání patogenů pomocí PRR vede k aktivaci a iniciaci efektorových funkcí makrofágů. Takto aktivovaný makrofág ničí intracelulární patogeny především produkcí baktericidních kyslíkových radikálů (ROS) a NO. Dokáže rovněž amplifikovat zánětlivou odpověď produkcí dalších prozánětlivých cytokinů, např. IL-1, IL-6 a TNF-α.[3]
M2 makrofágy
M2 makrofágy jsou asociovány se řadou fyziologických a patologických procesů, včetně homeostázy, ukončování zánětlivé imunitní odpovědi, metabolizmu, ale zároveň podporují růst nádorů. Hrají důležitou roli v regeneračních a remodelačních procesech vedoucích ke zhojení poškozené tkáně a promoci Th2 imunitní odpovědi. Vznikají především působením cytokinů IL-4 a IL-13. Tyto cytokiny dokážou potlačit následnou produkci IL-6 a TNF makrofágy. Získané poznatky o působení Th2 cytokinů ukazují, že mají spíše modulační, než inhibiční, účinek na funkci makrofágů - dochází tedy k jejich alternativní aktivaci.[4] Od M1 fenotypu se liší především neschopností prezentovat antigen, minimální produkcí ROS a NO a expresí specifických molekul, jako jsou např. iNOS, metaloproteázy a arginázy. Žádnou z těchto molekul ale nemůžeme použit jako marker pro determinaci M2. Za marker M2 můžeme považovat CD163, což je povrchový scavenger receptor pro zachytávání komplexu haptoglobinu-hemoglobinu. Nedokážeme ale s jistotou říct, že všechny CD163 pozitivní buňky jsou striktně M2 makrofágy. Většina studií, které se zabývají polarizací makrofágů, probíhají v in vitro podmínkách, které je nutno brát s nadhledem, jelikož nezachycují komplexitu podmínek in vivo. Je tedy vhodné používat kombinaci markerů pro odlišení populací M1 a M2. [5]
Fenotypy M2 makrofágů
M2 makrofágy se dále dělí do několika hlavních podtypů (fenotypů): M2a, M2b, M2c a M2d. Tyto fenotypy jsou popsány na základě odlišných stimulů, expresí odlišných genů a v závěru i odlišné efektorové funkce. Je ale nutné zdůraznit, že tyto podtypy mnohdy nelze spolehlivě odlišit, jelikož jde spíše o kontinuální spektrum fenotypu makrofágů než o striktně oddělené skupiny. Tyto fenotypy v sebe mohou i přecházet, a proto je určení konkrétního podtypu v praxi velice složité.
Prvním fenotypem jsou tzv. „alternativně aktivované“ M2a makrofágy, které se díky své produkci profibrotických faktorů uplatňují především při hojení ran. K indukci tohoto fenotypu dochází v prostředí s cytokiny IL-4 a IL-13. Aktivace transkripce genů typických pro tento fenotyp se spouští prostřednictvím transkripčních faktorů STAT6, IRF4 a PPAR-γ.[6] M2a makrofágy exprimují molekuly CD206 (také známo jako manózový receptor), CD163 a CD369 a produkují receptor pro IL-1 (IL-1R), TGF-β, CCL17 a inzulínu podobné růstové faktory (IGF).[7]
M2b makrofágy jsou označovány jako „regulační makrofágy“, jelikož řídí rozsah reakce v závislosti na hladinách cytokinů, které produkují. K indukci M2b fenotypu dochází kombinací imunokomplexů a agonistů Toll-like receptorů (jako např. lipopolysacharidu) nebo agonistů IL-1R. M2b makrofágy exprimují CD86, CCL1 a TNFSF14. U tohoto fenotypu dochází k produkci prozánětlivých cytokinů (IL-1β, IL-6, TNF-α), ale zároveň se tvoří i vysoké hladiny protizánětlivého cytokinu IL-10 za současně velice nízkých hladin IL-12. M2b makrofágy mají poměrně vysokou fagocytární kapacitu oproti M2a makrofágům.[8] M2b dokáží zamezit polarizaci monocytů na M1.[7]
M2c fenotyp je považován za „deaktivační makrofágy“. Indukuje se vysokými hladinami IL-10 a signalizace pak dále vede přes transkripční faktor STAT3 až k opětovné produkci IL-10 spolu s TGF-β. Díky těmto cytokinům působí M2c protizánětlivě a mají profibrotickou funkci. M2c exprimují vysoké hladiny Mer receptoru tyrosin kinázy (MerTK), což je činí dobrými fagocytujícími buňkami apoptotických tělísek. M2c dále exprimují i CD163, CD206, CCR2, TLR1 a pentraxin-3 (PTX3). [6][8]
M2d jsou známé též jako „tumor asociované makrofágy“ (TAMs). Tento fenotyp je indukován kostimulací TLR agonisty spolu s agonisty A2 adenosinového receptoru (A2R) nebo IL-6. Adenosin umožnuje inhibici působení TNF-α, IL-1 a IFN-γ tím, že se váže na jejich receptory. Charakteristický cytokinový profil pro tento fenotyp představuje vysoká produkce IL-10, TGF-β a vaskulárního endotelového růstového faktoru (vascular epithelial growth factor, VEGF) a naopak nízká produkce IL-12, TNF-α a IL-1β. Tento profil vede ke zvýšené angiogenezi a přispívá k nádorové metastázi.[6][7][8] TAMs se dají polarizovat, běžně jsou polarizované směrem k M2, kde přispívají k růstu nádorů, pokud se ale polarizují směrem k M1 fenotypu, představují slibný prostředek k inhibici nádorové progrese.[9]
Fenotypy makrofágů asociovaných s aterosklerotickými pláty
Spektrum fenotypů zahrnuje i další subtypy makrofágů, které byly původně nalezeny v aterosklerotických plátech: Mhem, Mox, M(Hb) a M4.
Prvním z nich jsou Mhem, které indukuje krevní hem. Exprimují CD163 a mají ateroprotektivní funkci. Tato funkce je zapříčiněna zejména jejich vysokou produkcí IL-10 a hem oxygenázy-1, které snižují hromadění lipidů a oxidativní stres v aterosklerotických plátech.[7]
Mox makrofágy vykazují fenotyp s rysy M1 i M2 makrofágů. Jsou indukované oxidovanými lipidy a exprimují TLR2 a nukleární transkripční faktor (nuclear erythroid-2 related factor – Nrf2). Působí antioxidačně díky své produkci IL-10 a COX2.[6][7]
M(Hb) jsou také indukované krevním hemem a jsou i dalším fenotypem makrofágů, který se nachází v aterosklerotických plátech. Exprimují CD163 a CD206, produkují IL-10 a zvyšují odtok cholesterolu, čímž zabraňují tvorbě pěnitých buněk při ateroskleróze. Také snižují produkci reaktivních forem kyslíku (reactive oxygen species, ROS) v aterosklerotických makrofázích.[6]
Posledním zmiňovaným typem jsou M4 makrofágy, které indukuje CXCL4. Mají sníženou expresi CD163, čímž působí ateroprotektivně, dále u nich pozorujeme expresi CD206 a metaloproteináz (MMP7). Produkují IL-6 a TNF-α.[6][7]
Kromě výše zmiňovaných existují ještě např. M17 a M3, které zatím nejsou dobře definované.
Funkce makrofágu
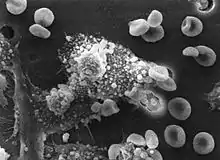
Základní funkcí makrofágu je fagocytóza. K dalším funkcím patří prezentace antigenu T-lymfocytům, řízení hemopoézy, hemostázy a hojení ran, regulace zánětu, destrukce mikroorganismů, odstraňování mrtvých buněk a cytotoxická reakce.
Fagocytóza
Fagocytóza je proces zajišťující pohlcení a zpracování cizích, nefunkčních, mrtvých či nemocných buněk a jiného korpuskulárního materiálu (velikost materiálu nad 100 nanometrů). Je to nejstarší imunitní děj; lze ho nalézt už u nižších živočichů.
Fáze fagocytózy
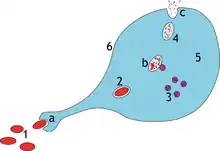
- přiblížení, chemotaxe
- rozpoznání, adherence, opsonizace
- ingesce (pohlcení) – vznik fagozomu
- splynutí fagozomu s lysozomem – vznik fagolysozomu
- digesce (trávení) ve fagolysozomu
- oxidativní vzplanutí – tvorba reaktivních kyslíkových radikálů, které zapříčiní zničení částice
- uvolnění produktů rozkladu z makrofágu
Prezentace antigenu
Další důležitou funkcí makrofágu je prezentace antigenu dalším buňkám imunitního systému. Makrofág prezentuje krátké peptidy (navázané na MHC) získané strávením pohlcené částice T-lymfocytům.

- Cizorodou částici rozpozná makrofág a fagocytuje ji
- Makrofág prezentuje antigen této částice
- Antigen-MHC II komplex, aktivace Th-lymfocytů
- Th-lymfocyty pak řídí imunitní odpověď organismu
Tato cesta může být posílena činností B-lymfocytů, které produkují protilátky.
Makrofág a zánět
Makrofág je většinou první buňka imunitního systému, která se dostává na místo zánětu. Provádí tam rychlou a nespecifickou reakci na škodlivinu. Teprve posléze se do místa zánětu dostávají buňky zajišťující specifickou reakci. Jejich činnost je s makrofágy propojena na základě prezentace antigenu.
Odkazy
Reference
- MILLS, Charles D.; KINCAID, Kristi; ALT, Jennifer M. M-1/M-2 Macrophages and the Th1/Th2 Paradigm. The Journal of Immunology. 2000-06-15, roč. 164, čís. 12, s. 6166–6173. PMID: 10843666. Dostupné online [cit. 2021-05-15]. ISSN 0022-1767. DOI 10.4049/jimmunol.164.12.6166. PMID 10843666.
- BIO-RAD. Macrophage Polarization - Mini-review. Bio-Rad [online]. [cit. 2021-05-15]. Dostupné online.
- WYNN, Thomas A.; CHAWLA, Ajay; POLLARD, Jeffrey W. Origins and Hallmarks of Macrophages: Development, Homeostasis, and Disease. Nature. 2013-04-25, roč. 496, čís. 7446, s. 445–455. PMID: 23619691 PMCID: PMC3725458. Dostupné online [cit. 2021-05-27]. ISSN 0028-0836. DOI 10.1038/nature12034. PMID 23619691.
- GORDON, Siamon; MARTINEZ, Fernando O. Alternative Activation of Macrophages: Mechanism and Functions. Immunity. 2010-05-28, roč. 32, čís. 5, s. 593–604. PMID: 20510870. Dostupné online [cit. 2021-05-15]. ISSN 1074-7613. DOI 10.1016/j.immuni.2010.05.007. PMID 20510870.
- BARROS, Mário Henrique M.; HAUCK, Franziska; DREYER, Johannes H. Macrophage Polarisation: an Immunohistochemical Approach for Identifying M1 and M2 Macrophages. PLOS ONE. 2013-11-15, roč. 8, čís. 11, s. e80908. Dostupné online [cit. 2021-05-15]. ISSN 1932-6203. DOI 10.1371/journal.pone.0080908.
- MOHMMAD‐REZAEI, Mina; AREFNEZHAD, Reza; AHMADI, Reza. An overview of the innate and adaptive immune system in atherosclerosis. IUBMB Life. 2021-01, roč. 73, čís. 1, s. 64–91. Dostupné online [cit. 2022-01-28]. ISSN 1521-6543. DOI 10.1002/iub.2425. (anglicky)
- NAKAI, Kozo. Multiple roles of macrophage in skin. Journal of Dermatological Science. 2021-10-01, roč. 104, čís. 1, s. 2–10. PMID: 34493430. Dostupné online [cit. 2022-01-28]. ISSN 0923-1811. DOI 10.1016/j.jdermsci.2021.08.008. PMID 34493430. (English)
- WANG, Le‐xun; ZHANG, Sheng‐xi; WU, Hui‐juan. M2b macrophage polarization and its roles in diseases. Journal of Leukocyte Biology. 2019-08, roč. 106, čís. 2, s. 345–358. Dostupné online [cit. 2022-01-28]. ISSN 0741-5400. DOI 10.1002/JLB.3RU1018-378RR. (anglicky)
- CHEN, Peiwen; PIAO, Xianhua; BONALDO, Paolo. Role of macrophages in Wallerian degeneration and axonal regeneration after peripheral nerve injury. Acta Neuropathologica. 2015-11, roč. 130, čís. 5, s. 605–618. Dostupné online [cit. 2022-01-28]. ISSN 0001-6322. DOI 10.1007/s00401-015-1482-4. (anglicky)
Literatura
- TOMAN, M. Imunologie pro farmaceuty. VFU, Brno 2004.
- MYSLIVEČEK, J., TROJAN, S. Fyziologie do kapsy. Triton, Praha 2004.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu makrofág na Wikimedia Commons
Obrázky, zvuky či videa k tématu makrofág na Wikimedia Commons