Oxid uhelnatý
Oxid uhelnatý (starší terminologií kysličník uhelnatý) je bezbarvý jedovatý plyn bez chuti a zápachu, nedráždivý. Ve vodě je málo rozpustný. Je obsažen ve svítiplynu, v generátorovém a ve vodním plynu; má silně redukční vlastnosti. V přírodě je přítomen v nepatrném množství v atmosféře, kde vzniká především fotolýzou oxidu uhličitého působením ultrafialového záření, jako produkt nedokonalého spalování fosilních paliv i biomasy. Je také obsažen v sopečných plynech. V mezihvězdném prostoru se vyskytuje ve značném množství. Byl nalezen i v atmosféře Marsu (0,08 %) a spektroskopicky prokázán v komě komet.
| Oxid uhelnatý | |
|---|---|
 | |

Schéma molekuly oxidu uhelnatého | |
| Obecné | |
| Systematický název | oxid uhelnatý |
| Latinský název | Carbonii monoxidum Monoxidum carbonis |
| Anglický název | Carbon monoxide |
| Německý název | Kohlenstoffmonoxid |
| Sumární vzorec | CO |
| Vzhled | bezbarvý jedovatý plyn bez zápachu |
| Identifikace | |
| Registrační číslo CAS | 630-08-0 |
| EC-no (EINECS/ELINCS/NLP) | 211-128-3 |
| Indexové číslo | 006-001-00-2 |
| PubChem | 281 |
| ChEBI | 17245 |
| UN kód | 1016 |
| SMILES | [C-]#[O+] |
| InChI | 1S/CO/c1-2 |
| Číslo RTECS | FG3500000 |
| Vlastnosti | |
| Molární hmotnost | 28,010 1 g/mol |
| Teplota tání | −205 °C (68 K) |
| Teplota varu | −191,5 °C (81 K) |
| Hustota | 789 kg/m³, (kapalný, tv) 0,001 25 g/cm³ (0 °C) 0,001 145 g/cm³ (25 °C) |
| Dynamický viskozitní koeficient | 0,005 61 cP (plyn, tv) 0,012 7 cP (−78,5 °C) 0,016 6 cP (0 °C) 0,021 8 cP (126 °C) 0,025 5 cP (227 °C) |
| Index lomu | nD= 1,000 34 (0 °C) |
| Kritická teplota Tk | −140,23 °C |
| Kritický tlak pk | 3 499 kPa |
| Kritická hustota | 0,301 g/cm3 |
| Rozpustnost ve vodě | 3,5 cm3/100 g (0 °C) 2,82 cm3/100 g (10 °C) 2,32 cm3/100 g (20 °C) 2,14 cm3/100 g (25 °C) 2,00 cm3/100 g (30 °C) 1,77 cm3/100 g (40 °C) 1,49 cm3/100 g (60 °C) 1,43 cm3/100 g (80 °C) 1,40 cm3/100 g (100 °C) |
| Rozpustnost v polárních rozpouštědlech |
karbonylové sloučeniny estery alkoholy |
| Relativní permitivita εr | 1,000 634 |
| Van der Waalsovy konstanty stavové rovnice | a= 0,148 5 Pa m6 mol−2 b= 39,85 m3 mol−1 |
| Součinitel tepelné vodivosti | 0,020 0 W m−1 K−1 (−40 °C) 0,021 8 W m−1 K−1 (−17 °C) 0,023 4 W m−1 K−1 (4,4 °C) 0,025 1 W m−1 K−1 (27 °C) 0,026 8 W m−1 K−1 (49 °C) |
| Ionizační energie | 14,013 eV |
| Struktura | |
| Dipólový moment | 0,374×10−30 C·m |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −110,53 kJ/mol −121 kJ/mol (vodný roztok) |
| Entalpie tání ΔHt | 29,8 J/g |
| Entalpie varu ΔHv | 215,6 J/g |
| Standardní molární entropie S° | 197,556 J/mol·K 105 J/mol·K (vodný roztok) |
| Standardní slučovací Gibbsova energie ΔGf° | −137,15 kJ/mol −199,9 kJ/mol (vodný roztok) |
| Izobarické měrné teplo cp | 1,039 5 J K−1 g−1 |
| Izochorické měrné teplo cV | 0,741 J K−1 g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H220 H360D H331 H372 |
| R-věty | R12, R23, R33, R48, R61 |
| S-věty | S9, S16, S33, S45, S53 |
| NFPA 704 |  2
4
2
|
| Teplota vzplanutí | − 191 °C |
| Teplota vznícení | 609 °C |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vznik
Vzniká z kyslíkatých organických látek rozkladem při vysokých teplotách. Např. při koksování uhlí. Nad 600 °C vzniká i při spalování ochotněji než oxid uhličitý.
Ve vysoké peci se získává vysokoteplotním spalováním koksu:
- 2C + O2 → 2CO
Endotermní reakcí vodní páry s koksem za vysokých teplot se vyráběl vodní plyn jako ušlechtilé palivo nebo zdroj vodíku:
- C + H2O → CO + H2
Vzniká také při výrobě vodíku parním reformováním methanu endotermní reakcí okolo 1000 °C:
- CH4 + H2O → 3 H2 + CO
Následně se ale spotřebovává konverzí pod 600 °C, kdy redukuje vodní páru:
- CO + H2O → H2 + CO2
V nepatrném množství vzniká i metabolickými procesy v živých organismech a proto je obsažen ve stopových množstvích ve vydechovaném vzduchu z plic.
Vlastnosti
S kyslíkem hoří namodralým plamenem na oxid uhličitý:
- 2CO + O2 → 2CO2
za uvolnění značného množství tepla. Ve směsi, obsahující od 12,5 do 74,2 % [2] oxidu uhelnatého ve vzduchu, reakce probíhá jako výbuch. I při nižší koncentraci tato reakce probíhá dobře na katalyzátoru výfukových plynů.
CO má podobnou hustotu jako vzduch, nepatrně nižší (97 %).
Využití
Oxid uhelnatý se dříve používal jako plynné palivo (například součást svítiplynu). Jeho směs s vodíkem (vodní plyn) byl jedním z meziproduktů používaných v těžkém chemickém a potravinářském[3] průmyslu. Při výrobě železa vzniká oxid uhelnatý z uhlíku v koksu a spolu s ním funguje jako redukční činidlo.
Zdroje oxidu uhelnatého a jeho výskyt v ovzduší
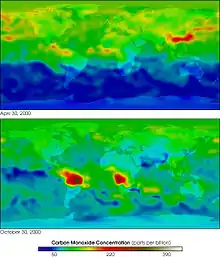
Vzhledem k jedovatosti je jednou z významných znečišťujících látek. Vzniká při vysokoteplotním spalování uhlíku a organických látek. Je emitován např. automobily, lokálními topeništi, energetickým a metalurgickým průmyslem.
CO vzniká zejména pokud:
- je teplota spalování příliš nízká, než aby mohlo dojít k úplné oxidaci pohonných látek na oxid uhličitý,
- čas hoření ve spalovací komoře je příliš krátký,
- není k dispozici dostatek kyslíku.
Díky povinnému zavedení řízených katalyzátorů u vozidel s benzínovými motory se emise oxidu uhelnatého v poslední době snižují.
V roce 2005 v České republice nepřekračovaly pozaďové koncentrace 300 µg/m3. V Praze činily roční aritmetické průměry v oblastech zatížených dopravou přibližně 1.000 µg/m3.[4]
Při používání zemního plynu k vaření v domácnostech je koncentrace CO v domácím ovzduší průměrně cca 2.900 µg/m3 [5].
Kouření
Významným zdrojem oxidu uhelnatému je kouření. Lidé kouřící cca 20 cigaret denně mají asi 4 až 7 % krevního hemoglobinu zablokováno působením CO.[4] Při pasivním kouření je člověk vystaven koncentracím okolo 1.700 µg/m3 [5].
Účinky na živé organismy
Toxicita
Oxid uhelnatý je značně jedovatý; jeho jedovatost je způsobena silnou afinitou k hemoglobinu (krevnímu barvivu), s nímž vytváří karboxyhemoglobin (COHb), čímž znemožňuje přenos kyslíku v podobě oxyhemoglobinu z plic do tkání. Vazba oxidu uhelnatého na hemoglobin je přibližně dvousetkrát silnější než kyslíku, a proto jeho odstranění z krve trvá mnoho hodin až dní. Příznaky otravy se objevují již při přeměně 10 % hemoglobinu na karboxyhemoglobin.
Otrava oxidem uhelnatým
Oxid uhelnatý blokuje přenášení kyslíku krví, neboť jeho vazba s hemoglobinem je 200× až 300× pevnější než vazba kyslíku a z hemoglobinu se stává karboxyhemoglobin. Otrava CO se vyskytuje např. v uzavřených prostorech, kde běží spalovací motory nebo při špatném odvětrání plynových spotřebičů. První pomoc spočívá v přerušení kontaktu (vyvětrat, vynést z prostoru), dále podání kyslíku a pokud došlo k zástavě oběhu, je třeba resuscitovat.
Oxidem uhelnatým (ve svítiplynu) se otrávil například Jiří Šlitr.[6]
Signalizační molekula
Oxid uhelnatý patří spolu s oxidem dusnatým a sulfanem ke gasotransmiterům; působí (podobně jako oxid dusnatý) jako relaxant na hladkosvalové buňky ve stěnách cév (vasodilatační účinek).
Odkazy
Reference
- Carbon monoxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- http://www.biotox.cz/toxikon/anorgan/ja_4a.php – IV.A skupina - skupina uhlíku
- Spotřebitelé jí maso ošetřené jedovatým plynem
- Miroslav Šuta: Účinky výfukových plynů z automobilů na lidské zdraví (druhé, přepracované a doplněné vydání, Děti Země 2008, ISBN 80-86678-10-5
- Carbon Monoxide - International Programme on Chemical Safety - Environmental Health Criteria 213. www.inchem.org [online]. [cit. 2009-09-18]. Dostupné v archivu pořízeném dne 2013-11-04.
- Svítiplynem se otrávil skladatel Jiří Šlitr - Česká televize
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu oxid uhelnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu oxid uhelnatý na Wikimedia Commons - (česky) Už víte vše o otravě oxidem uhelnatým? – Informační servis ČSTZ 2/2006
- (česky) Oxid uhelnatý zabíjí...


