Izochorický děj
Izochorický děj je termodynamický děj, při kterém zůstává konstantní objem termodynamické soustavy. Při izochorickém ději je tedy , tedy .
Ideální plyn
V případě ideálního plynu lze pro izochorický děj ze stavové rovnice odvodit Charlesův zákon
- ,
kde je tlak a je termodynamická teplota plynu. Při izochorickém ději je tedy podíl tlaku a termodynamické teploty ideálního plynu stálý.
Izochora
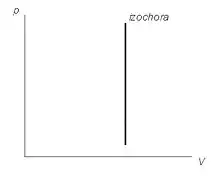
Závislost tlaku na objemu při izochorickém ději je v p-V diagramu vyjádřena přímkou rovnoběžnou s osou p, která se nazývá izochora.
Vlastnosti
Pro termodynamické systémy schopné konat pouze objemovou práci (nebo u kterých je konání jiných druhů práce zanedbatelné) platí:
Poněvadž se při izochorickém ději nemění objem , bude podle první věty termodynamické platit vztah
- ,
kde je teplo a je vnitřní energie.
Protože je objemová práce vykonaná plynem (nebo dodaná plynu), lze tvrdit, že . To znamená, že při izochorickém ději plyn nevykonává (ani nepřijímá) žádnou práci.
Při izochorickém ději je všechno dodané (nebo odevzdané) teplo použito na zvýšení (nebo snížení) vnitřní energie .
Teplo dodané plynu zvýší jeho teplotu o . K vyjádření tohoto tepla lze použít molární tepelnou kapacitu při stálém objemu , tedy
- ,
kde je látkové množství. Integrací tohoto vztahu dostaneme
Vztah pro entropii při vratném izochorickém ději lze vyjádřit pomocí předchozích vztahů ve tvaru
Dodáme-li soustavě při vratném izobarickém ději stejné množství tepla jako při vratném ději izochorickém, bude přírůstek teploty plynu při izobarickém ději menší než při izochorickém ději. Pro molární tepelné kapacity tedy platí .
Vztah mezi a určuje Poissonova konstanta a Mayerův vztah.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Izochorický děj na Wikimedia Commons
Obrázky, zvuky či videa k tématu Izochorický děj na Wikimedia Commons