Kyselina ftalová
Kyselina ftalová je aromatická dikarboxylová kyselina. Racionální vzorec je C6H4(COOH)2 a jedná se o bílou krystalickou látku. Patří do skupiny ftalových kyselin a jejími izomery jsou kyseliny isoftalová a tereftalová.
| Kyselina ftalová | |
|---|---|
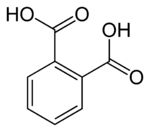
Strukturní vzorec | |
Prostorový model | |
| Obecné | |
| Systematický název | kyselina benzen-1,2-dikarboxylová |
| Triviální název | kyselina ftalová |
| Anglický název | phthalic acid |
| Funkční vzorec | C6H4(COOH)2 |
| Sumární vzorec | C8H6O4 |
| Vzhled | bezbarvá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 88-99-3 |
| Vlastnosti | |
| Molární hmotnost | 166,14 g/mol |
| Teplota tání | 210 °C |
| Hustota | 1,593 g/cm³ |
| Disociační konstanta pKa | pKa1=2,943 pKa2 = 5,432 |
| Rozpustnost ve vodě | málo rozpustná |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustná |
| Bezpečnost | |
| [1] Varování[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Využití
Kyselina ftalová se v chemickém průmyslu používá k výrobě barviv (např. fenolftaleinu a naftoftaleinu), změkčovadel na bázi ftalátů (nejčastěji DEHP – bis(2-ethylhexyl) ftalát), sacharinu a k výrobě syntetických voňavek.
Historie
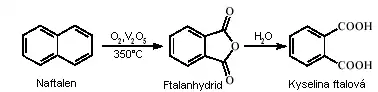
Kyselina ftalová byla poprvé vyrobena v roce 1836 francouzským chemikem Augustem Laurenem oxidací naftalenu, který ji ve víře, že se jedná o kyselinu odvozenou od naftalenu, pojmenoval kyselina naftalenová. První, kdo objevil strukturu ftalové kyseliny byl Švýcar Jean Charles Galissard de Marignac, který kyselině ftalové dal její správné jméno.
Chemie
Při průmyslové výrobě se vychází z o-xylenu nebo naftalenu. Ty jsou v plynné fázi oxidovány vzdušným kyslíkem na katalyzátoru na bázi oxidu vanadičného za vzniku ftalanhydridu. Kyselina se z ftalanhydridu získává hydrolýzou, většinou se ale při dalších reakcích vychází přímo z ftalanhydridu, který je mimo jiné dostupnější.
Kyselina ftalová jako dvojsytná kyselina poskytuje dvě řady solí. Hydrogenftalát draselný se používá jako primární standard při acidobazických titracích.
Jako jedna z mála odštěpuje kyselina ftalová při dostatečném zahřátí vodu a vzniká její anhydrid – ftalanhydrid, který za této teploty sublimuje. Vznik anhydridu je umožněn vznikem výhodného pětičlenného kruhu. Kyselina i její anhydrid se používají k výrobě barevných indikátorů (fenolftalein).
Reference
- Phthalic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina ftalová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina ftalová na Wikimedia Commons
