Fenolftalein
Fenolftalein je organická aromatická sloučenina. Často se používá při acidobazických titracích jako indikátor.
| Fenolftalein | |
|---|---|
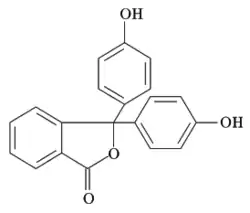
Struktura fenolftaleinu | |
| Obecné | |
| Systematický název | 3,3-bis(4-hydroxyfenyl)-2-benzofuran-1(3H)-on |
| Triviální název | fenolftalein |
| Ostatní názvy | 3,3-bis(4-hydroxyfenyl)isobenzofuran-1(3H)-on |
| Anglický název | Phenolphthalein |
| Německý název | Phenolphthalein |
| Sumární vzorec | C20H14O4 |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 77-09-8 |
| EC-no (EINECS/ELINCS/NLP) | 201-004-7 |
| Indexové číslo | 604-076-00-1 |
| PubChem | 4764 |
| SMILES | O=C1OC(c2ccccc12)(c3ccc(O)cc3)c4ccc(O)cc4 |
| InChI | 1S/C20H14O4/c21-15-9-5-13(6-10-15)20(14-7-11-16(22) 12-8-14)18-4-2-1-3-17(18)19(23)24-20/h1-12,21-22H |
| Vlastnosti | |
| Molární hmotnost | 318,323 g/mol |
| Teplota tání | 262,5 °C |
| Hustota | 1,277 g/cm3 (32 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H350 H341 H361f |
| R-věty | R45 R62 R68 |
| S-věty | S53 S45 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Fenolftalein byl poprvé připraven roku 1871 německým chemikem Adolfem von Baeyerem reakcí fenolu s ftalanhydridem, z čehož pochází název fenolftalein. Reakce probíhá za katalýzy kyseliny sírové a za tepla (nesmí dojít k přehřátí, protože by se rozpadal ftalanhydrid). Při reakci vzniká jako vedlejší produkt voda.
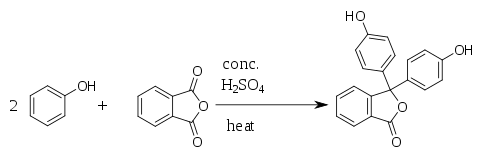
Titrace
Při acidobazických titracích se využívá barevného přechodu fenolftaleinu při změně pH. V kyselém prostředí je fenolftalein bezbarvý, v bazickém prostředí se zbarví fialově. K přechodu dochází při pH 8,2-9,8. Fenolftalein se používá ve formě roztoku v ethanolu.
| Sloučenina | H3In+ | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| Struktura | 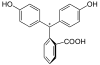 | 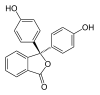 | 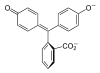 | 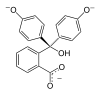 |
| Model | 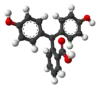 | 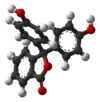 | 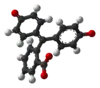 | 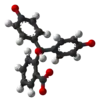 |
| pH | < 0 | 0 až 8,2 | 8,2 až 12,0 | > 12,0 |
| Prostředí | silně kyselé | kyselé až slabě zásadité | zásadité | silně zásadité |
| Barva | oranžová | bezbarvá | růžová až fialová | bezbarvá |
| Obrázek |  |  |
Užití
Fenolftalein se používá jako projímadlo. V současné době se od jeho použití ustupuje z důvodu možné karcinogenity.
Fenolftalein společně s peroxidem vodíku se používá při testování přítomnosti krve v Kastleho-Meyerově testu.
Další použití nachází při výrobě hraček, například mizejících inkoustů. Inkoust je smíchán s hydroxidem sodným, který reaguje se vzdušným oxidem uhličitým. Při reakci vzniká uhličitan sodný a klesá pH inkoustu. Pokles pH způsobí přechod fenolftaleinu z fialové do bezbarvé formy.

Reference
V tomto článku byl použit překlad textu z článku Phenolphtalein na anglické Wikipedii.
- Phenolphthalein. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
