Kyselina chlorsírová
Kyselina chlorsírová (také nazývaná kyselina chlorsulfonová) je anorganická sloučenina se vzorcem HClSO3. Jedná se o silně hygroskopickou bezbarvou kapalinu, která má výrazné slzotvorné účinky.[2] Soli a estery této kyseliny se nazývají chlorsírany.
| Kyselina chlorsírová | |
|---|---|
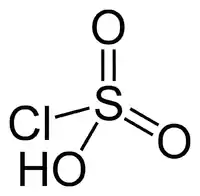
Strukturní vzorec | |
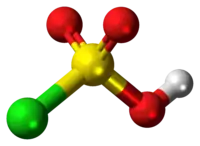
Model molekuly | |
| Obecné | |
| Systematický název | kyselina chlorsírová |
| Ostatní názvy | kyselina chlorsulfonová |
| Sumární vzorec | HClSO3 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 7790-94-5 |
| PubChem | 24638 |
| SMILES | ClS(=O)(=O)O |
| InChI | 1S/ClHO3S/c1-5(2,3)4/h(H,2,3,4) |
| Číslo RTECS | FX5730000 |
| Vlastnosti | |
| Molární hmotnost | 116,52 g/mol |
| Teplota tání | −80 °C (193 K) |
| Teplota varu | 151 až 152 °C (424 až 425 K) (100,7 kPa) |
| Hustota | 1,753 g/cm3 |
| Index lomu | 1,433 |
| Rozpustnost ve vodě | rozkládá se |
| Rozpustnost v polárních rozpouštědlech |
reaguje s alkoholy |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustná v chlorovaných uhlovodících |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R14 R35 R37 |
| S-věty | S2 S26 S45 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura a vlastnosti
Atom síry v molekule kyseliny chlorsírové má tetraedrickou konfiguraci. Je přechodnou sloučeninou mezi chloridem sulfurylu (SO2Cl2) a kyselinou sírovou (H2SO4).[3] Tuto kyselinu se málokdy podaří získat v čisté podobě; za přítomnosti nadbytku oxidu sírového vytváří pyrosulfurylchloridy:[4]
- 2 ClSO3H + SO3 → H2SO4 + S2O5Cl2
Výroba a příprava
Průmyslově se kyselina chlorsírová vyrábí reakcí chlorovodíku s oxidem sírovým rozpuštěným v kyselině sírové:[4]
- HCl + SO3 → ClSO3H
V laboratoři ji lze připravit chlorací kyseliny sírové:
Použití
Kyselina chlorsírová se používá na přípravu alkylsulfátů, používaných jako tenzidy:
- ROH + ClSO3H → ROSO3H + HCl
Sacharin se v minulosti získával reakcí toluenu s kyselinou chlorsírovou za vzniku ortho- a para-toluensulfonylchloridu:
- CH3C6H5 + 2 ClSO2OH → CH3C6H4SO2Cl + H2SO4 + HCl
Oxidací ortho-toluensulfonylchloridu vznikal derivát kyseliny benzoové, který se následně cyklizoval reakcí s amoniakem; z takto získaného produktu po neutralizaci zásadou vznikal sacharin.
Bezpečnost
Kyselina chlorsírová nebezpečně reaguje s vodou za vzniku kyseliny sírové a chlorovodíku.
Reference
V tomto článku byl použit překlad textu z článku Chlorosulfuric acid na anglické Wikipedii.
- Chlorosulfonic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- R. J. Cremlyn. Chlorosulfonic Acid. [s.l.]: Royal Society of Chemistry, 2002. ISBN 978-0-85404-498-6.
- A. F. Holleman; E. Wiberg. Inorganic Chemistry. [s.l.]: Academic Press, 2001. S. 549–550.
- J. Maas; F. Baunack. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2002. Kapitola Chlorosulfuric Acid.
Externí odkazy
 Obrázky, zvuky či videa k tématu Kyselina chlorsírová na Wikimedia Commons
Obrázky, zvuky či videa k tématu Kyselina chlorsírová na Wikimedia Commons

