Metody kvalitativní analýzy
Kvalitativní analýza je společné označení pro ty metody analytické chemie, které zjišťují, jaké chemické látky (prvky nebo sloučeniny) jsou obsaženy ve zkoumané látce. Nezajímá se o jejich množství.
Existuje mnoho metod, které se liší jak svojí náročností, tak i požadavky na laboratorní vybavení.
Srážecí analýza
Zakládá se na preferovaném průběhu reakcí ke vzniku sraženiny, pokud to je možné (sraženina se skoro nemůže účastnit reakce, proto je rovnováha posunuta silně na její stranu). Je velmi jednoduchá, jen vyžaduje mít po ruce více vzorků zkušebních látek.
Pomocí přidávání vhodných aniontů při testu na kationt a kationtů při testu na aniont a podle tabulky srážecích reakcí je možné několika málo testy ve zkumavce jednoznačně určit přítomnost dané látky. Pokud se jedná o směs, je to pochopitelně složitější, nicméně možné. Pokud by se při reakci mohlo vylučovat více sraženin, bude preferována ta, která má nižší součin rozpustnosti.
Dalším typem reakcí, při kterém je rovnováha posunuta k jejich vzniku, jsou reakce komplexotvorné nebo uvolňující plyn. Komplexy můžou být i rozpustné: proto lze na složení látek soudit i z případné změny barvy roztoku.
Sulfanová zkouška podle skupin kationtů
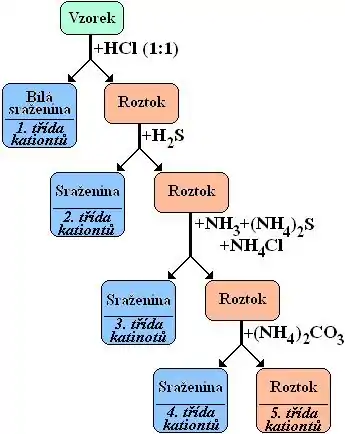
Kationty se dělí do 5 skupin (tříd) podle svých charakteristických vlastností, (jakým je např. skupinové činidlo, se kterým vytvářejí sraženiny určitých barev) díky nimž se dají i poměrně snadno dokazovat ve směsi.
- Kationty I. třídy tvoří sraženinu s HCl. Patří sem:Ag+, Hg22+, Pb2+. Olovo bývá řazeno i do II. skupiny.
- Kationty II. třídy tvoří v kyselém prostředí (pH 0,5) sraženinu s H2S a dělíme je dále na 2 podskupiny:
- Kationty III. třídy - Sulfidy jsou nerozpustné v alkalickém prostředí (pH 8,5). Zn2+, Ni2+, Co2+, Mn2+, Fe2+, Fe3+,Al3+ a Cr3+
- Kationty IV. třídy tvoří (v zhruba neutrálním prostředí) nerozpustné uhličitany. Ba2+, Ca2+, a Sr2+
Chromatografie
Chromatografie (z řečtiny χρώμα – barva, γραφειν – psát) je souhrnné označení pro skupinu fyzikálně-chemických separačních metod. Molekuly analytu se u všech typů chromatografických separací rozdělují mezi stacionární a mobilní fázi. Dělení je založeno na rozdílné distribuci složek směsi mezi mobilní a stacionární fázi.
Pro analytické účely se používá převážně TLC (tenkovrstvá chromatografie na destičce s vrstvou Al2O3) nebo plynová chromatografie (vzorek je odpařen a unášen plynem skrz trubici s práškem).
Spektroskopie
Spektroskopické metody se zakládají na různé pohltivosti (absorpci) látek nebo na jejich schopnosti vyzařovat (emitovat) světlo pro různé vlnové délky.
Rozlišujeme infračervenou, viditelnou a ultrafialovou spektroskopii, to odpovídá různým sériím přechodů elektronů v rámci vrstev (Lymanova série (UV), Balmerova série (viditelné světlo), Paschenova série (IR) apod.). Po rozložení na hranolu nebo difrakční mřížce pozorujeme buďto absorpční čáry, které látka pohltila při prosvícení bílým světlem, nebo emisní čáry, pokud látka sama vyzařuje.
Její výhodou je nedestruktivní povaha.
Dělení dle částic stanovované látky
- UV/VIS spektroskopie je založena na měření změn, které nastávají na molekulách při absorpci elektromagnetického záření v ultrafialové a viditelné oblasti (UV a VIS). Absorpční spektrum molekul obsahuje na rozdíl od atomů absorpční pásy, přičemž intenzita pásu se vyjadřuje pomocí absorpčního koeficientu ε, jehož hodnota se zjistí z Lambertova-Beerova zákona zákona.
- Atomová absorpční spektroskopie (AAS) měří absorpci elektromagnetického záření při vlnové délce 190-850 nm volnými atomy. Tvoří-li absorpční prostředí volné atomy - vznikne atomové spektrum - absorpční čára. Platnost Bouguer-Lambert-Beerova zákona pro kvantitativní stanovení.
- Atomová emisní spektroskopie (AES) je založena zkoumání spektra záření, které vydává vzorek zahřátý na vysokou teplotu. Kvalitativní složení vzorku se určuje podle polohy čar v emisním spektru (vlnových délek, které vzorek vysílá). Kvantitativní obsah jednotlivých složek vzorku ovlivňuje intenzitu čar.[1][2]
Hmotnostní spektrometrie
Hmotnostní spektrometrie rozděluje látky na základě toho, jak se jejich ionty chovají v elektrickém a magnetickém poli (síla na jednotkový náboj je konstantní, ale zrychlení je nepřímo úměrné hmotnosti, umožňuje proto i přesnou separaci izotopů, je ale velmi energeticky náročná).
Nukleární magnetická rezonance (NMR)
Spektroskopie nukleární magnetické resonance neboli NMR spektroskopie (zkratka NMR pochází z angl. Nuclear magnetic resonance (spectroscopy)) je fyzikálně-chemická metoda využívající interakce atomových jader (s nenulovým jaderným spinem, např. 1H, 13C) s magnetickým polem. Zkoumá rozdělení energií jaderného spinu v magnetickém poli a přechody mezi jednotlivými spinovými stavy vyvolané působením radiofrekvenčního záření. Interpretací NMR spekter lze zjistit strukturu molekul ve vzorku, metoda je využívána i při analýze biomolekul.
Odkazy
Reference
- NĚMCOVÁ, Irena; RYCHLOVSKÝ, Petr; ČERMÁKOVÁ, Ludmila. Spektrometrické analytické metody. Praha: Karolinum, 1998. ISBN 80-7184-365-2.
- MILDE, David. Optická emisní spektrometrie [online]. 2005-20017 [cit. 2021-01-28]. Dostupné online. (česky)[nedostupný zdroj]
Externí odkazy
 Obrázky, zvuky či videa k tématu Metody kvalitativní analýzy na Wikimedia Commons
Obrázky, zvuky či videa k tématu Metody kvalitativní analýzy na Wikimedia Commons