Kationty III. třídy
Kationty III. třídy je skupina kationtů sulfanové zkoušky srážecí analýzy. Do III. třídy řadíme: Co2+, Ni2+, Mn2+, Zn2+, Fe2+, Fe3+, Al3+, Cr3+. Srážecím skupinovým činidlem je směs (NH4)2S + NH4OH + NH4Cl (tzv. amoniakální pufr)
Důkazové zkoušky reakcí kationtů
Co2+
- + 1-nitroso-2-naftol → růžovohnědá sraženina
- + S2− → CoS černá sraženina
- + SCN− → [Co(SCN)4]2− modrý roztok
- + K+ + NO2− + H3O+ → K3[Co(NO2)6] žlutá sraženina – Fischerova sůl
- + NH3 → Co(NH3)2 modro/černá sraženina + OH− (přebytek) → [Co(NH3)6]2+ hnědozelený až hnědý roztok (platí pokud roztok neobsahuje amonnou sůl)
Ni2+
- + diacetyldioxim (čugajevovo činidlo) → jahodově červená sraž.
- + silný hydroxid → Ni(OH)2 (sv. zelená sraženina)
- + CO32− → NiCO3 zelená sraženina
- + [Fe(CN)6]4− → Ni2[Fe(CN)6] tyrkysově zelená sraž.
- + [Fe(CN)6]3− → Ni3[Fe(CN)6]2 Karamelově hnědá sraž.
- + NH3 → Ni(NH3)2 modrý roztok
Mn2+
- + H2O2
- + PbO2
- + NaBiO3
- → u všech tří reakcí vznikne růžový ʘ
- + S2− → MnS růžovo bílá sraženina (pleťová)
- + OH → Mn(OH)2 (bílá sraženina, ale rychle se oxiduje na hnědou MnO(OH)2
- + CO32− → Mn(CO)3 bílá, hnědnoucí sraženina
Zn2+
- + S2− → ZnS bílá sraženina
- + [Fe(CN)6]4− → Zn2[Fe(CN)6] bílá sraženina
- + [Fe(CN)6]3− → Zn3[Fe(CN)6]2 hnědo žlutá sraženina
Fe2+
- + [Fe(CN)6]3− → Fe3[Fe(CN)6]2 turbulova modř (tyrkysová sraženina)
- + [Fe(CN)6]4− → Fe2[Fe(CN)6] Žlutá krevní sůl (sraženina, bílá s modrým nádechem)
Fe3+
- + SCN− → Fe[Fe(SCN)6] krvavě červený ʘ
- + [Fe(CN)6]4− → Fe4[Fe(CN)6]3 berlínská modř
- + [Fe(CN)6]3− → Fe[Fe(CN)6] hnědý roztok
- + I− (jodido škrobové činidlo) → Fe2+ + I2 modro červený roztok
- + OH− → Fe(OH)3 zrzavá sraženina
Al3+
- + NH4OH → bílá sraženina
- + aluminon → červený Al lak
- + Al(NH3)3 + alizarin → červený lak hlinitý (sraženina)
- + NH3 → Al(NH3)3 bílá sraženina + NH3 (přebytek) → X
- + NaOH → Al(OH)3 bílá sraženina + NaOH(přebytek) → Na[Al(OH)4] bezbarvý roztok
- + Co(NO3)2 (solce kobaltnatá) →žíhání→ Co3(AlO3)2 ternardova modř
Cr3+
- + H2O2
- + benzidinová modř
- → u obou vznikne modrá sraženina
- + OH {(NH4)2S v amoniakálním pufru(NH3OH + NH4Cl)} → Cr(OH)3 šedo modro zelená sraženina
- + OH {NH3} → Cr(OH3) + NH3 + [Cr(NH3)6](OH)3 fialový roztok
- + OH {NaOH} → Cr(OH3) + NaOH + [Cr(OH)6]3− zelený roztok
Důkaz kationtů v komplexním vzorku
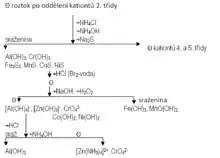
Postup
Filtrát po vysrážení kationtů II. třídy povaříme na vodní lázni. Přidáme asi 0.5 ml nasyceného roztoku NH4Cl a zneutralizujeme NH4OH (1:1). Potom se do směsi po několik minut zavádí sulfan (sulfan lze ve všech třídách vyměnit za Na2S). Sraženina se odfiltruje a roztok se uchová pro důkazy kationtů IV. a V. třídy. Sraženina sulfidů a hydroxidů se dvakrát promyje 0,5 ml NH4OH a rozpustí se v co nejmenším množství HCl (1:1) za varu. Je-li přítomen nikl a kobalt (sraženina sulfidů byla černá a nerozpouští se v HCl), musí se rozpouštění podpořit přidáním bromové vody a intenzivním mícháním. Do vzniklého čirého roztoku se přidá 25% NaOH do zřetelně alkalické reakce a malé množství tuhého Na2O2 (lze zaměnit za kapalný H2O2) a opatrným povařením se rozloží nadbytek peroxidu (až ustane šumění). Vzniklá sraženina se odfiltruje a analyzuje se na přítomnost železa, manganu, kobaltu a niklu. Ve filtrátu se dokazuje hliník, zinek a chrom.
Roztok obsahující tetrahydroxohlinitanový aniont, trihydroxozinečnatanový aniont a chromanový aniont okyselíme HCl (1:1) do kyselé reakce a neutralizujeme ji nadbytkem NH4OH (1:1) Je-li přítomen hliník, vznikne bílá rosolovitá sraženina Al(OH)3. Odfiltruje se, promyje vodou s přídavkem několika kapek CH3COOH (1:3), přidá se několik kapek 20% CH3COONH4 a za varu se sráží 5% Ba(NO3)2. Žlutá sraženina BaCrO4 se odfiltruje a provede se další důkaz chromu. V roztoku dokazujeme zinek.
Literatura
- Analytická chemie-1, SNTL, Praha 1984