Kofaktor (biochemie)
Kofaktor je nízkomolekulární nebílkovinná složka enzymu, která je nezbytná pro jeho katalytickou aktivitu. Kofaktorem může být chemická sloučenina nebo kovový iont, který je potřebný pro roli enzymu jako katalyzátoru. Hlavní funkcí kofaktoru je přenos atomů, molekul nebo elektronů při chemické reakci, která je katalyzována enzymem. Enzymů, které potřebují ke své enzymatické reakci kofaktor je většina, odhaduje se asi 60 %.
Enzym s navázaným kofaktorem se nazývá holoenzym a má katalytickou funkci. Enzym tvořený pouze bílkovinnou složkou bez kofaktoru se nazývá apoenzym a nemá katalytickou funkci.
Enzymy jsou obvykle proteiny s aktivním místem schopným enzymatické reakce. Na toto místo jsou právě navázány kofaktory. Enzymů je velké množství a podle jejich enzymatické reakce se dělí do sedmi skupin:
- oxidoreduktázy - katalyzují oxidoredukční děje
- transferázy - katalyzují přenos atomů, molekul, iontů
- hydrolázy - katalyzují rozkladnou reakci, kde je činitelem rozkladu voda
- lyázy - katalyzují rozklad chemických vazeb často za vzniku dvojných vazeb nebo nových cyklických sloučenin
- izomerázy - katalyzují vzájemné přeměny izomerů
- ligázy - katalyzující napojování molekul za současného odštěpení molekul s malou molární hmotností
- translokasy - umožňují průběh translace (syntézu bílkovin) pomocí jednoho z bakteriálních elongačních faktorů (EF-G - Elongation Factor G), tedy proteinů, které umožňují postup ribozomu podél vlákna mRNA.
Terminologie
Terminologie kofaktorů, koenzymů a prostetických skupin je značně nejednotná. Voet & Voet rozlišují dva druhy kofaktorů, koenzymy a prostetické skupiny, z nichž první se vážou slabě a druhé kovalentně.[1] Stejné pojetí zastává například Vodrážkova Enzymologie[2] nebo Oxford Dictionary of Biochemistry and Molecular Biology.[3] Poněkud jiné definice používá například Alberts[4] nebo Harper.[5]
Článek z roku 1980 v časopise Trends in Biochemistry Sciences kritizoval svévolné rozlišování mezi koenzymy a protetickými skupinami. Kofaktory definoval jako další látku kromě bílkoviny enzymu, která je k němu volně vázána a je potřebná pro aktivitu enzymu. Prostetickou skupinu definoval jako látku, která je připojená k jediné molekule enzymu a prochází celým katalytickým cyklem. Ani tato definice nebyla zcela přijata.
Dělení kofaktorů
Molekula kofaktorů je často tvořena heterocyklickou sloučeninou. Mnoho kofaktorů jsou deriváty vitamínů rozpustných ve vodě. Některé kofaktory váží molekuly kovů nebo jsou samy tvořeny kovy (stopové prvky - mangan, železo, kobalt, nikl, měď, zinek nebo molybden).
Kofaktory se dělí do dvou základních skupin:
- anorganické kofaktory, metaloenzymy (například kovové ionty Mg2+, Cu2+, Mn2+, Fe2+ nebo S4+). Ke známým metaloenzymům patří metaloproteázy, alkoholdehydrogenáza či karbonáthydrolyáza.[2]
- organické kofaktory se dělí na koenzymy a prostetické skupiny (například flavin nebo hem)
Mezi kofaktory se obvykle neřadí další nebílkovinné součásti enzymů, jako například různé cukerné složky nebo ionty kovů. Je to proto, že mnohé enzymy jsou glykoproteiny nebo metaloproteiny.
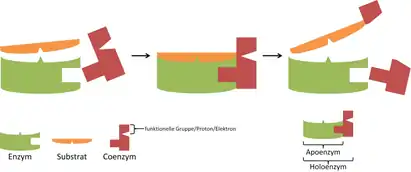
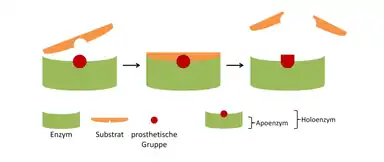
Koenzymy
Kofaktor, který je na enzym vázán jen slabě a je schopen přecházet z jedné bílkovinné složky enzymu (apoenzymu) na druhou, se nazývá koenzym. Regenerace koenzymu obvykle probíhá pomocí spřažených reakcí. Koenzym, který reagoval při reakci, přechází na jiný apoenzym, kde se v jiné chemické reakci opět vrací do původního stavu.
Prostetické skupiny
Kofaktor, který je pevně navázán na bílkovinnou složku a je tedy stabilní součástí molekuly enzymu, se nazývá prostetická skupina. Regenerace prostetické skupiny probíhá tak, že enzym krátce po sobě reaguje se dvěma různými substráty.
Příklady enzymů
Oxidoreduktázy
Kofaktory oxidoreduktáz se účastní oxidačních a redukčních pochodů[2]:
- pyridinové (nikotinamidové) (di)nukleotidy – koenzymy NAD+ a NADP+; spolupracují s oxidoreduktázami, které díky nim jsou schopné odnímat atomy vodíku z různých alkoholových nebo aldehydických sloučenin
- flavinové „nukleotidy“ – kofaktory FMN a FAD; jsou obvykle pevnou součástí umožňují odebírat vodíkové nebo kyslíkové atomy z chemických sloučenin.
- biopterin – vzácnější kofaktor, které opět spolukatalyzuje redoxní reakce (např. hydroxylaci fenylalaninu na tyrosin v enzymu L-fenylalaninhydroxyláze)
- kyselina lipoová – kofaktor, který umožňuje dehydrogenaci aldehydických skupin na karboxylové skupiny tím, že přijímá dva vodíkové atomy a otevírá disulfidový kruh
- benzochinony s izoprenoidním postranním řetězcem – koenzym Q10 a plastochinon; jsou to akceptory vodíku pracující v důležitých energetických drahách
- hem – prostetická skupina, které je složkou řady peroxidáz, kataláz a cytochromů; centrální železo může tvořit ferri- nebo ferro- formu a tím se oxidovat/redukovat.
- FeS centra – tyto složky FeS proteinů se mnohdy chovají jako prostetické skupiny enzymů a účastní se celé řady fundamentálních procesů, jako je např. fixace CO2 a N2
- glutathion – přenáší vodíkové atomy díky své schopnosti měnit thiolovou skupinu na cyklus
Transferázy
Kofaktory transferáz umožňují přenos skupin[2]:
- ATP – umožňuje fosforylovat cílovou molekulu a je složkou tzv. kináz. Spotřebováním ATP vzniká ADP či vzácněji dokonce AMP.
- aktivní sulfát (PAPS) – složka jiné skupiny transferáz, která se spotřebovává za současného přenosu sulfátové skupiny
- adenosylmethionin a methylkobalamin – složky enzymů schopných přenášet methylovou skupinu
- tetrahydrofolát – různé varianty tohoto kofaktoru přenáší formylové skupiny, hydroxymethyly a další uhlíkové fragmenty
- biotin – přenáší oxid uhličitý a je schopný jej zabudovat jako karboxyl
- thiamindifosfát – thiaminový kofaktor, jenž přenáší dvojuhlíkové štěpy a katalyzuje dekarboxylaci alfa-oxokyselin
- koenzym A – přenáší aktivovaný acetyl a další acyly vazbou na thiolovou skupinu
- pyridoxalfosfát – katalyzuje transaminační reakce aminokyselin
- uridindifosfát – přenáší zejména aktivní glukózu a je součástí transglykosidáz účastnících se tvorby polysacharidů
- cytidindifosfát – přenáší cytidindifosfocholin nebo cytidindifosfofosfatidovou kyselinu na vhodný akceptor, např. diacylglycerol
Ligázy
Lligázy (syntetázy) katalyzující napojování molekul za současného odštěpení molekul s malou molární hmotností:
- Aminoacyl-tRNA syntetáza, která katalyzuje napojení aminokyseliny k příslušné tRNA.
- DNA ligáza, enzym často používaný v molekulární biologii ke spojení DNA fragmentů.
Translokázy
- translokasy - umožňují průběh translace (syntézu bílkovin) pomocí jednoho z bakteriálních elongačních faktorů (EF-G - Elongation Factor G), tedy proteinů, které umožňují postup ribozomu podél vlákna mRNA.
Reference
V tomto článku byly použity překlady textů z článků Cofactor (biochemistry) na anglické Wikipedii a Cofaktor (Biochemie) na německé Wikipedii.
Literatura
- VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha: Victoria Publishing, 1995. ISBN 80-85605-44-9.
- VODRÁŽKA, Zdeněk; RAUSCH, Pavel; KÁŠ, Jan. Enzymologie. [s.l.]: VŠCHT v Praze, 1998.
- Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- ALBERTS, Bruce , et al. The Molecular Biology of the Cell. [s.l.]: Garland Science, 2002. (4th. ed). ISBN 0-8153-3218-1.
- MURRAY, Robert K., Daryl K. Granner, Peter A. Mayes, Victor W. Rodwell. Harper's Illustrated Biochemistry. [s.l.]: Lange Medical Books/McGraw-Hill; Medical Publishing Division, 2003. ISBN 0-07-138901-6.
Externí odkazy
 Obrázky, zvuky či videa k tématu kofaktor na Wikimedia Commons
Obrázky, zvuky či videa k tématu kofaktor na Wikimedia Commons