Hexamethylfosforamid
Hexamethylfosforamid, také HMPA, je organická sloučenina patřící mezi fosforamidy (amidy kyseliny fosforečné). Tato bezbarvá kapalina se používá jako aprotické polární rozpouštědlo a jako přídavná látka v organické syntéze.
| Hexamethylfosforamid | |
|---|---|
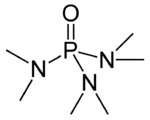
Strukturní vzorec | |
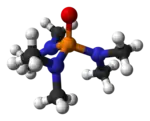
Model molekuly | |
| Obecné | |
| Systematický název | Hexamethylfosfortriamid |
| Ostatní názvy | HMPA |
| Sumární vzorec | C6H18N3OP |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 680-31-9 |
| PubChem | 12679 |
| ChEBI | 24565 |
| SMILES | O=P(N(C)C)(N(C)C)N(C)C |
| InChI | 1S/C6H18N3OP/c1-7(2)11(10,8(3)4)9(5)6/h1-6H3 |
| Vlastnosti | |
| Molární hmotnost | 179,20 g/mol |
| Teplota tání | 7,2 °C (280,4 K) |
| Teplota varu | 232,5 °C (505,2 K) |
| Rozpustnost ve vodě | mísitelný |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Teplota vzplanutí | 104,4 °C (377,6 K) |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura a reaktivita
HMPA je oxidem silně zásaditého triamidu hexamethylfosforitého (HMPT), P(NMe2)3. Podobně jako u ostatních fosfinoxidů (jako například trifenylfosfinoxidu) má jeho molekula čtyřstěnné jádro a vazba P-O je velmi polarizována, takže na kyslíkovém atomu je výrazný záporný náboj.
HMPA se stejně jako mnohé další sloučeniny obsahující vazbu dusík-fosfor rozkládá působením kyseliny chlorovodíkové za vzniku protonovaného aminu a fosforečnanu.
Použití
HMPA se používá jako rozpouštědlo polymerů, plynů a organokovových sloučenin. Upravuje selektivitu lithiačních reakcí rozpadem oligomerů organolithných zásad jako je butyllithium. Jelikož HMPA selektivně solvatuje kationty, tak urychluje jinak pomalé SN2 reakce tvorbou více „nahých“ aniontů. Zásaditá dusíková centra v HMPA se silně koordinují na Li+.[2]
HMPA je ligandem u mnoha užitečných činidel založených na molybdenu a peroxidech, například MoO(O2)2(HMPA)(H2O) se používá jako oxidační činidlo v organické syntéze.[3]
Alternativní činidla
HMPA používaný jako rozpouštědlo lze nahradit dimethylsulfoxidem. Obě tyto látky jsou silnými akceptory vodíkových vazeb a jejich kyslíkové atomy vážou kovové kationty. Dalšími alternativami k HMPA jsou N,N′-tetraalkyldetriváty močoviny[4][5] a 1,3-dimethyl-2-imidazolidinon (DMI).[6]
Toxicita
HMPA je pouze mírně toxickou látkou ale u krys byla prokázána jeho karcinogenita.[2] Mnoho organických chemiků jej kvůli tomu považuje za mimořádně nebezpečnou látku a snaží jeho použití vyhnout vždy, když je to možné. Pomocí kyseliny chlorovodíkové lze HMPA přeměnit na méně škodlivé látky.
Reference
V tomto článku byl použit překlad textu z článku Hexamethylphosphoramide na anglické Wikipedii.
- Hexamethylphosphoramide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Dykstra, R. R. Encyclopedia of Reagents for Organic Synthesis. Hexamethylphosphoric Triamide. New York: John Wiley & Sons, 2001. DOI 10.1002/047084289X.rh020. (anglicky)
- DICKMAN, Michael H.; POPE, Michael T. Peroxo and Superoxo Complexes of Chromium, Molybdenum, and Tungsten. Chemical Reviews. 1994, s. 569–84. DOI 10.1021/cr00027a002. (anglicky)
- Mukhopadhyay, T.; SEEBACH, D. Substitution of HMPT by the Cyclic Urea DMPU as a Cosolvent for highly Reactive Nucleophiles and Bases. Helvetica Chimica Acta. 1982, s. 385–391. DOI 10.1002/hlca.19820650141. (anglicky)
- Beck, A. K.; SEEBACH, D. Encyclopedia of Reagents for Organic Synthesis. N,N'-Dimethylpropyleneurea. New York: John Wiley & Sons, 2001. DOI 10.1002/047084289X.rd366. (anglicky)
- LO, C. C.; CHAO, P. M. Replacement of Carcinogenic Solvent HMPA by DMI in Insect Sex Pheromone Synthesis. Journal of Chemical Ecology. 1992, s. 3245–3253. Dostupné v archivu pořízeném dne 2016-03-04. DOI 10.1007/BF00982095. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Hexamethylfosforamid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hexamethylfosforamid na Wikimedia Commons
