Fukujamova redukce
Fukuyjamova redukce je organická redoxní reakce, ve které se redukují thioestery na aldehydy pomocí hydrosilanů za přítomnosti palladia jako katalyzátoru.
Reakci objevil Tóru Fukujama v roce 1990.[1] V původní reakci byly použity triethylsilan a palladium na uhlíku:
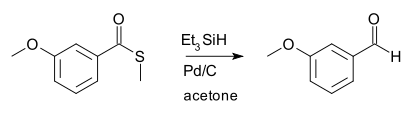
Fukujamovy redukce se používají k přeměnám karboxylových kyselin (sloužících jako prekurzory thioesterů) na aldehydy; tyto přeměny jsou obecně obtížné, protože často dochází k pokračování redukce za vzniku alkoholu.
Mechanismus
Katalytický cyklus Fukujamovy redukce vypadá takto:
Rozsah
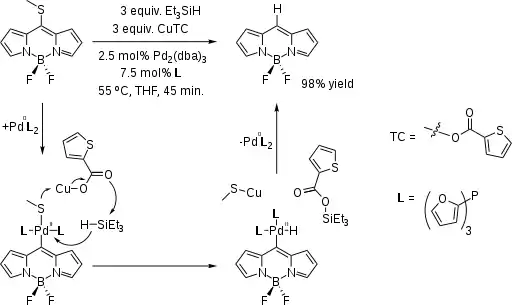
V jedné z obměn Fukujamovy redukce byla vytvořena sloučenina BODIPY z SMe-substituovaného derivátu:[2] Dalšími reaktanty jsou thiofen-2-karboxylát měďný (CuTC), tris(dibenzylidenaceton)dipalladium (Pd(dba)2) a tris(2-furyl)fosfin.
Podobnou reakcí je Fukujamovo párování, kde se místo hydridu vyskytuje karboaniontový nukleofil.
Reference
V tomto článku byl použit překlad textu z článku Fukuyama reduction na anglické Wikipedii.
- Facile reduction of ethyl thiol esters to aldehydes: application to a total synthesis of (+)-neothramycin A methyl ether Tohru Fukuyama, Shao Cheng Lin, Leping Li Journal of the American Chemical Society, 1990, 112 (19), pp 7050–7051 DOI:10.1021/ja00175a043
- The Smallest and One of the Brightest. Efficient Preparation and Optical Description of the Parent Borondipyrromethene System. I. J. Arroyo, R. Hu, G. Merino, B. Z. Tang, E. Peña-Cabrera, The Journal of Organic Chemistry 2009, ASAP