Fluoroform
Fluoroform (systematický název trifluormethan) je fluorovaný derivát uhlovodíku s chemickým vzorcem CHF3. Patří mezi haloformy (trihalomethany), skupinu sloučenin se vzorcem CHX3 (X = halogen). Cíleně se vyrábí a používá se pro řadu různých aplikací (reaktant, prekurzor, chladivo, hasivo). Dále se získává jako vedlejší produkt při výrobě PTFE. V malém množství vzniká také biologicky, dekarboxylací kyseliny trifluoroctové.[2]
| Fluoroform | |
|---|---|

Strukturní vzorec fluoroformu | |
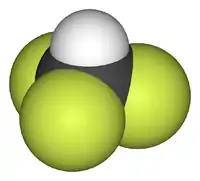
Model molekuly | |
| Obecné | |
| Systematický název | trifluormethan |
| Triviální název | fluoroform |
| Ostatní názvy | R-23, HFC-23, FE-13, Fluoryl |
| Anglický název | Fluoroform |
| Německý název | Fluoroform |
| Sumární vzorec | CHF3 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 75-46-7 |
| EC-no (EINECS/ELINCS/NLP) | 200-872-4 |
| PubChem | 6373 |
| ChEBI | 24073 |
| UN kód | 1984 |
| SMILES | FC(F)F |
| InChI | 1S/CHF3/c2-1(3)4/h1H |
| Číslo RTECS | PB6900000 |
| Vlastnosti | |
| Molární hmotnost | 70,01 g/mol |
| Teplota tání | −155,2 °C |
| Teplota varu | −82,1 °C |
| Disociační konstanta pKa | 25–28 |
| Rozpustnost ve vodě | 0,1 g/100 ml |
| Tlak páry | 4,38 MPa (20 °C) |
| Bezpečnost | |
| [1] Varování[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Syntéza
Fluoroform byl poprvé získán Mauricem Meslansem při bouřlivé reakci jodoformu (trijodmethanu) se suchým fluoridem stříbrným v roce 1894.[3] Tuto reakci vylepšil Otto Ruff náhradou fluoridu stříbrného směsí fluoridu rtuťnatého a vápenatého.[4] Záměnná reakce funguje s jodoformem a bromoformem, záměna prvních dvou halogenových atomů fluorem probíhá velmi prudce. Albert Henne toto přeměnil na dvoustupňový proces; v prvním kroku reakcí fluoridu antimonitého s bromoformem vzniká bromdifluormethan, ve druhém se pak jeho reakcí s fluoridem rtuťnatým získá fluoroform. Byla to první účinná metoda syntézy fluorformu.[4]
Průmyslové aplikace
CHF3 se používá v polovodičovém průmyslu k plazmovému leptání oxidu a nitridu křemičitého.
Pod názvem R-23 či HFC-23 se používá jako užitečné chladivo, případně jako náhrada za chlortrifluormethan (R-13) - je vedlejším produktem jeho výroby.
Používá se také jako hasivo (obchodní značka FE-13) díky nízké toxicitě, nízké reaktivitě a vysoké hustotě. Nahradil dříve používaný bromtrifluormethan v plynových zhášecích systémech.
Organická chemie
CHF3 je prekurzorem pro přípravu CF3− deprotonací. Molekula je slabě kyselá s pKa = 25–28. Dále je prekurzorem pro CF3Si(CH3)3[5]
Skleníkový plyn
CHF3 je silným skleníkovým plynem. Sekretariát Clean Development Mechanism odhaduje, že tuna fluoroformu má v atmosféře stejné účinky jako 11 700 tun oxidu uhličitého. Novější práce (IPCC, 2007) naznačuje, že tato ekvivalence, nazývaná také stoletý potenciál globálního oteplování, je ještě o něco vyšší: 14 800.[6] Životnost fluoroformu v atmosféře je 270 let.[6]
Podle zprávy IPCC o klimatu z roku 2007 byl fluoroform zhruba do roku 2001 nejhojnějším fluorovaným uhlovodíkem v atmosféře, než ho překonal 1,1,1,2-tetrafluorethan (R-134a), nyní často používaný v automobilových klimatizacích. Globální emise fluoroformu pocházely v minulosti převážně z bezděčné produkce a uvolňování při výrobě chladiva R-22 (chlordifluormethanu).
Data v databázi emisí skleníkových plynů UNFCCC [7] ukazují významný pokles emisí fluoroformu ve vyspělých zemích od 90. let 20. století do prvního desetiletí 21. století. Projekty UNFCCC Clean Development Mechanism poskytují od roku 2003 prostředky a podporu pro odstranění emisí fluoroformu vznikajícího jako vedlejší produkt při výrobě R-22 v rozvojových zemích. Podle dat Ozone Secretariat of the World Meteorological Organization se právě rozvojové země staly v posledních letech hlavními producenty chlordifluormethanu.[8] Emise všech fluorovaných uhlovodíků jsou zahrnuty do kjótského protokolu. CHF3 lze likvidovat pomocí elektrického oblouku nebo vysokoteplotním spalováním.
Související články
Reference
V tomto článku byl použit překlad textu z článku Fluoroform na anglické Wikipedii.
- Trifluoromethane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Kirschner, E., Chemical and Engineering News 1994, 8.
- Meslans M. M. Recherches sur quelques fluorures organiques de la série grasse. Annales de chimie et de physique. 1894, s. 346–423. Dostupné online. (anglicky)
- Henne A. L. Fluoroform. Journal of the American Chemical Society. 1937, s. 1200–1202. DOI 10.1021/ja01286a012. (anglicky)
- Rozen, S.; Hagooly, A. "Fluoroform" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289
- Forster, P., V. Ramaswamy, P. Artaxo, T. Berntsen, R. Betts, D.W. Fahey, J. Haywood, J. Lean, D.C. Lowe, G. Myhre, J. Nganga, R. Prinn, G. Raga, M. Schulz and R. Van Dorland (2007). "Changes in Atmospheric Constituents and in Radiative Forcing.". Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change.
- http://unfccc.int/di/FlexibleQueries.do
- Archivovaná kopie. ozone.unep.org [online]. [cit. 2011-09-03]. Dostupné v archivu pořízeném dne 2011-07-21.
Literatura
- McBee E. T. Fluorine Chemistry. Industrial & Engineering Chemistry. 1947, s. 236–237. DOI 10.1021/ie50447a002. (anglicky)
- Oram D. E., Sturges W. T., Penkett S. A., McCulloch A., Fraser P. J. Growth of fluoroform (CHF3, HFC-23) in the background atmosphere. Geophysical Research Letters. 1998, s. 236–237. Dostupné v archivu pořízeném dne 2011-06-06. DOI 10.1029/97GL03483. (anglicky)
- McCulloch A. Fluorocarbons in the global environment: a review of the important interactions with atmospheric chemistry and physics. Journal of Fluorine Chemistry. 2003, s. 21–29. DOI 10.1016/S0022-1139(03)00105-2. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluoroform na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluoroform na Wikimedia Commons - MSDS at Oxford University
- MSDS at mathesontrigas.com
- Coupling of fluoroform with aldehydes using an electrogenerated base
