Chlortrifluormethan
Chlortrifluormethan, také nazývaný CFC-13 nebo R-13, je organická sloučenina, halogenderivát methanu. Není žíravý ani hořlavý. Používá se jako chladivo, ovšem jelikož poškozuje ozonovou vrstvu, je jeho používání omezováno kvůli Montrealskému protokolu. Také je to silný skleníkový plyn (1400krát silnější než oxid uhličitý).
| Chlortrifluormethan | |
|---|---|
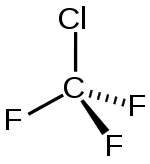
Strukturní vzorec | |

Model molekuly | |
| Obecné | |
| Systematický název | Chlor(trifluor)methan |
| Ostatní názvy | CFC-13, R-13 |
| Anglický název | Chlorotrifluoromethane |
| Sumární vzorec | CClF3 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 75-72-9 |
| PubChem | 6392 |
| SMILES | ClC(F)(F)F |
| InChI | 1/CClF3/c2-1(3,4)5 |
| Číslo RTECS | PA6410000 |
| Vlastnosti | |
| Molární hmotnost | 104,459 g/mol |
| Teplota tání | −181 °C (92 K) |
| Teplota varu | −81,5 °C (191,6 K) |
| Hustota | 1,526 g/cm3 |
| Kritická teplota Tk | 28,8 °C (302,0 K) |
| Kritický tlak pk | 3,86 MPa |
| Kritická hustota | 0,57 g/cm3 |
| Rozpustnost ve vodě | 0,009 g/100 ml |
| Tlak páry | 3,263 MPa (21 °C) |
| Bezpečnost | |
| [1] Varování[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Chlortrifluormethan lze vyrobit reakcí tetrachlormethanu s fluorovodíkem za přítomnosti katalytického množství chloridu antimoničného:
- CCl4 + 3HF → CClF3 + 3HCl
Při této reakci rovněž vznikají trichlorfluormethan, dichlordifluormethan a tetrafluormethan.
Reference
V tomto článku byl použit překlad textu z článku Chlorotrifluoromethane na anglické Wikipedii.
- Chlorotrifluoromethane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu chlortrifluormethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlortrifluormethan na Wikimedia Commons
Portály: Chemie | Životní prostředí
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.

