Fluorid vápenatý
Fluorid vápenatý (CaF2) je iontová sloučenina vápníku a fluoru. Je téměř nerozpustná ve vodě. V přírodě se vyskytuje nejčastěji jako fialový nebo zelenomodrý nerost fluorit (kazivec) a je zdrojem většiny světového fluoru. Tato pevná látka má plošně centrovanou krychlovou strukturu, kde je vápník umístěn mezi osm fluoridových aniontů a každý F− je obklopen čtyřmi ionty Ca2+.[2] Přestože jako čistá látka je bezbarvý, jako minerál je zbarven díky přítomnosti F-center.
| Fluorid vápenatý | |
|---|---|
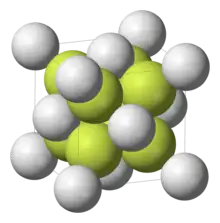
Krystalická mřížka | |

Práškový fluorid vápenatý | |
| Obecné | |
| Systematický název | Fluorid vápenatý |
| Anglický název | Calcium fluoride |
| Německý název | Calciumfluorid |
| Sumární vzorec | CaF2 |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7789-75-5 |
| Číslo EC (enzymy) | 232-188-7 |
| Číslo RTECS | EW1760000 |
| Vlastnosti | |
| Molární hmotnost | 78,08 g/mol |
| Teplota tání | 1 360 °C |
| Teplota varu | 2 500 °C |
| Hustota | 3,18 g/cm3 |
| Rozpustnost ve vodě | 0,001 6 g/100 g (18 °C) 0,001 7 g/100 g (26 °C) |
| Součin rozpustnosti | 2,69×10−11 |
| Relativní permitivita εr | 7,36 |
| Měrná magnetická susceptibilita | −4,26 Sm−1 |
| Struktura | |
| Krystalová struktura | Krychlová plošně centrovaná |
| Hrana krystalové mřížky | a=548,6 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −1 214,6 kJ/mol |
| Standardní molární entropie S° | 68,87 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −1 161,9 kJ/mol |
| Izobarické měrné teplo cp | 0,887 JK−1g−1 |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | Žádné nejsou |
| S-věty | Žádné nejsou |
| Teplota vznícení | Není vznětlivý |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Využití
Zdroj fluorovodíku
Přírodní CaF2 je základním zdrojem fluorovodíku, látky používané pro výrobu široké škály materiálů. Fluorovodík se z minerálu uvolňuje působením koncentrované kyseliny sírové:
Výsledný fluorovodík se převádí na fluor, fluorouhlíky a rozličné fluoridy. Koncem 90. let 20. století se těžilo ročně 5 milionů tun CaF2.[3]
Jiná použití
Fluorid vápenatý se běžně používá jako materiál pro optické účely, jak pro oblast infračerveného, tak ultrafialového záření, protože záření těchto vlnových délek (0,15 až 9 µm) výborně propouští a má extrémně nízký index lomu. Navíc je tento materiál poměrně chemicky inertní, takže nepodléhá korozi. Nicméně při vlnových délkách okolo 157 nm, které jsou užitečné pro výrobce polovodičů, index lomu fluoridu vápenatého překračuje únosnou mez. Tento problém lze zmírnit optimalizací procesu růstu krystalu. Je to zvláště důležité, pokud jde o ultrafialový optický materiál pro integrované obvody vyráběné litograficky. Canon používá u některých svých čoček "L" (Canon L lens) také uměle krystalizovaný fluorid vápenatý, který má nižší světelnou disperzi. U infračervených optických materiálů je fluorid vápenatý někdy znám jako obchodní značka "Irtran-3" firmy Eastman Kodak, ale toto označení je zastaralé.
Fluorid vápenatý dopovaný uranem byl druhým vynalezeným typem pevnolátkového laseru (60. léta 20. století). Peter Sorokin a Mirek Stevenson z laboratoří IBM v Yorktown Heights (USA) představili laser pracující na vlnové délce 2,5 µm krátce po Maimanově rubínovém laseru.
CaF2 se používá také jako tavidlo pro zpracování železa, oceli a jejich slitin. Účinek je založen na podobném bodu tání, jako má železo, na schopnosti rozpouštět oxidy a na schopnosti smáčet oxidy a kovy.
Bezpečnost
Fluoridy jsou pro člověka toxické, avšak CaF2 se považuje za poměrně neškodný, vzhledem k jeho nízké rozpustnosti. Situace je podobná jako u síranu barnatého, kde toxicita normálně spjatá s Ba2+ je potlačena velmi nízkou rozpustností síranu.
Reference
V tomto článku byl použit překlad textu z článku Calcium fluoride na anglické Wikipedii.
- Calcium fluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- G. L. Miessler and D. A. Tarr “Inorganic Chemistry” 3rd Ed, Pearson/Prentice Hall publisher, ISBN 0-13-035471-6.
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Související články
Příbuzné látky
- Fluorid barnatý
- Fluorid hořečnatý
- Fluorid lithný
- Chlorid vápenatý
Externí odkazy
 Obrázky, zvuky či videa k tématu fluorid vápenatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu fluorid vápenatý na Wikimedia Commons - Hornické muzeum Harrachov
- Společnost Fluorit Teplice s.r.o.
