Fenantrolin
Fenantrolin, přesněji 1,10-fenantrolin (jako ligand zkráceně phen) je heterocyklická organická sloučenina, bílá pevná látka rozpustná v organických rozpouštědlech. Používá se jako ligand v koordinační chemii, s většinou kovových iontů vytváří silné vazby.[3][4] Často je prodáván jako monohydrát.
| Fenantrolin | |
|---|---|

Strukturní vzorec 1,10-fenantrolinu | |

Vzorek 1,10-fenantrolinu | |
| Obecné | |
| Systematický název | 1,10-fenantrolin |
| Sumární vzorec | C12H8N2 |
| Vzhled | bezbarvé krystaly |
| Identifikace | |
| Registrační číslo CAS | 66-71-7 |
| EC-no (EINECS/ELINCS/NLP) | 200-629-2 |
| PubChem | 1318 |
| ChEBI | 44975 |
| SMILES | c1cc2ccc3cccnc3c2nc1 |
| InChI | 1S/C12H8N2/c1-3-9-5-6-10-4-2-8-14-12(10)11(9)13-7-1/h1-8H |
| Číslo RTECS | SF8300000 |
| Vlastnosti | |
| Molární hmotnost | 180,21 g/mol |
| Teplota tání | 117 °C (390 K)[1] |
| Teplota varu | 409 °C (682 K)[2] |
| Hustota | 1,31 g/cm3 |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v acetonu a ethanolu[2] |
| Bezpečnost | |
| [1] | |
| H-věty | H301 H400 H410[1] |
| P-věty | P264 P270 P273 P301+310 P321 P330 P391 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Fenantrolin se připravuje dvojicí po sobě jdoucích Skraupových reakcí glycerolu s o-fenylendiaminem, katalyzovaných kyselinou sírovou, za přítomnosti oxidačního činidla, kterým bývá vodný roztok kyseliny arseničné nebo nitrobenzen.[5]
Dehydratací glycerolu se vytvoří akrolein , který poté zkondenzuje s aminem a následně proběhne cyklizace.
Koordinační chemie
Fenantrolin má podobné koordinační vlastnosti jako 2,2'-bipyridin (bipy), ale jeho vazby na kovy jsou pevnější; fenantrolin je ovšem slabším donorem než bipy.[6]
Je známa řada homoleptických komplexů této sloučeniny, jako je [Fe(phen)3]2+, nazývaný ferroin, využívaný ke spektrofotometrickému stanovení železnatých iontů.[7]
Ferroin je také používán jako redoxní indikátor, se standardním elektrodovým potenciálem +1,06 V. Redukovaná železnatá forma je tmavě červená a oxidovaná železitá má barvu světle modrou.[8]
Ružový komplex [Ni(phen)3]2+ má vzájemně oddělitelné Δ a Λ izomery.[9]
Komplex s měďnými kationty, [Cu(phen)2]+, vykazuje luminescenci.[10][11]
Bioanorganická chemie
Analog ferroinu [Ru(phen)3]2+ má bioaktivní vlastnosti.[12]
1,10-fenantrolin je inhibitorem metalopeptidáz, například karboxypeptidázy A.[13]
Inhibice probíhá skrze chelataci a odpojení kovových iontů potřebných ke katalytické aktivitě enzymu, čímž vznikne neaktivní apoenzym. 1,10-fenantrolin inhibuje hlavně metalopeptidázy obsahující zinek, jeho aktivita vůči vápníku je výrazně nižší.[14]
Podobné ligandy
Jako ligandy byly použity i mnohé deriváty fenantrolinu.[11]
Substituenty v pozicích 2,9 chrání navázaný kov, když brání navázání více ekvivalentů fenantrolinu. Samotný fenantrolin vytváří působením dihalogenidů kovů komplexy typu [M(phen)3]Cl2 (M = Fe, Co, Ni). Neokuproin a bathokuproin oproti tomu tvoří 1:1 komplexy, jako je [Ni(neo/batho-kuproin)Cl2]2.[15]
| ligand | pKa | poznámka/jiný název | obrázek |
|---|---|---|---|
| 1,10-fenantrolin | 4,86 | phen | 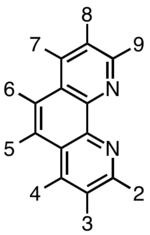 Číslování derivátů 1,10-fenantrolinu |
| 2,2'-bipyridin | 4,30 | méně zásaditý než phen | |
| 5-nitro-1,10-fenantrolin | 3,57 | ||
| 2,9-dimethyl-1,10-fenantrolin | není známo | neokuproin | |
| 4,7-dimethyl-1,10-fenantrolin | 5,97 | ||
| 4,7-difenyl-1,10-fenantrolin | není známo | bathofenantrolin | |
| 5,6-dimethyl-1,10-fenantrolin | 5,20 | ||
| 3,4,7,8-tetramethylfenantrolin | 6,31 | 3,4,7,8-Me4phen | |
| 4,7-dimethoxy-1,10‐fenantrolin | 6,45 | 4,7-(MeO)2phen[17] |
Použití jako indikátor alkyllithných činidel
Alkyllithiné sloučeniny vytvářejí s fenantrolinem výrazně zbarvené produkty. Obsah alkyllithných sloučenin v roztoku lze určit přidáním malého množství fenantrolinu (přibližně 1 mg) a následnou titrací alkoholy do odbarvení roztoku.[18] Podobně je možné titrovat i Grignardova činidla.[19]
Odkazy
Související články
Externí odkazy
- CRC Handbook of Chemistry and Physics. Redakce Haynes, William M.. 97th. vyd. [s.l.]: CRC Press, 2016. ISBN 9781498754293. S. 3.444. (anglicky)
Reference
V tomto článku byl použit překlad textu z článku Phenanthroline na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/1318
- CRC Handbook of Chemistry and Physics. Redakce Haynes, William M.. 97th. vyd. [s.l.]: CRC Press, 2016. ISBN 9781498754293. S. 3.444. (anglicky)
- Luman, C. R. and Castellano, F. N. (2003) "Phenanthroline Ligands" in Comprehensive Coordination Chemistry II. Elsevier. ISBN 978-0-08-043748-4.
- Peter G. Sammes; Gokhan Yahioglu. 1,10-Phenanthroline: A versatile ligand. Chemical Society Reviews. 1994, s. 327. DOI 10.1039/cs9942300327.
- Barbara E. Halcrow; William O. Kermack. 43. Attempts to find new antimalarials. Part XXIV. Derivatives of o-phenanthroline (7 : 8 : 3′ : 2′-pyridoquinoline). Journal of the Chemical Society. 1946, s. 155–157. DOI 10.1039/jr9460000155. PMID 20983293.
- Qiaoqiao Teng; Han Vinh Huynh. A unified ligand electronic parameter based on C NMR spectroscopy of N-heterocyclic carbene complexes. Dalton Transactions. 2017, s. 614–627. DOI 10.1039/C6DT04222H. PMID 27924321.
- R. Belcher. Application of chelate Compounds in Analytical Chemistry. Pure and Applied Chemistry. 1973, s. 13–27. DOI 10.1351/pac197334010013.
- G. B. Bellér; G. B. Lente; I. N. Fábián. Central Role of Phenanthroline Mono-N-oxide in the Decomposition Reactions of Tris(1,10-phenanthroline)iron(II) and -iron(III) Complexes. Inorganic Chemistry. 2010, s. 3968–3970. DOI 10.1021/ic902554b. PMID 20415494.
- George B. Kauffman; Lloyd T. Takahashi. Resolution of the tris-(1,10-Phenanthroline)Nickel(II) Ion. Inorganic Syntheses. 1966, s. 227–232. ISBN 9780470132395. DOI 10.1002/9780470132395.ch60.
- N. Armaroli. Photoactive Mono- and Polynuclear Cu(I)-Phenanthrolines. A Viable Alternative to Ru(Ii)-Polypyridines?. Chemical Society Reviews. 2001, s. 113–124. DOI 10.1039/b000703j.
- A. J. Pallenberg; K. A. Koenig; D. M. Barnhart. Synthesis and Characterization of Some Copper(I) Phenanthroline Complexes. Inorganic Chemistry. 1995, s. 2833–2840. DOI 10.1021/ic00115a009.
- F. P. Dwyer; Eleonora C. Gyarfas; W. P. Rogers; Judith H. Koch. Biological Activity of Complex Ions. Nature. 1952, s. 190–191. DOI 10.1038/170190a0. Bibcode 1952Natur.170..190D.
- Jean-Pierre Felber; Thomas L. Coombs; Bert L. Vallee. The mechanism of inhibition of carboxypeptidase A by 1,10-phenanthroline. Biochemistry. 1962, s. 231–238. DOI 10.1021/bi00908a006. PMID 13892106.
- G. S. Salvesen; H. Nagase. Proteolytic Enzymes: A Practical Approach. [s.l.]: Oxford University Press, 2001. ISBN 9780199636624. Kapitola Inhibition of proteolytic enzymes, s. 105–130.
- H. S. Preston; C. H. L. Kennard. Crystal Structure of di-mu-Chloro-sym-trans-Dichloro-Bis-(2,9-Dimethyl-1,10-Phenanthroline)dinickel(II)-2-Chloroform. Journal of the Chemical Society A. 1969, s. 2682–2685. DOI 10.1039/J19690002682.
- J. G. Leipoldt; G. J. Lamprecht; E. C. Steynberg. Kinetics of the substitution of acetylacetone in acetylactonato-1,5-cyclooctadienerhodium(I) by derivatives of 1,10-phenanthroline and 2,2′-dipyridyl. Journal of Organometallic Chemistry. 1991, s. 259–263. DOI 10.1016/0022-328X(91)83069-G.
- Ryan A. Altman. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2008. ISBN 978-0471936237. DOI 10.1002/047084289X.rn00918. Kapitola 1,10-Phenanthroline, 4,7-Dimethoxy.
- FAGAN, PAUL J.; NUGENT, WILLIAM A. 1-Phenyl-2,3,4,5-Tetramethylphosphole. Org. Synth.. 1998. Dostupné online. (anglicky); Coll. Vol.. S. 653. (anglicky)
- Ho-Shen Lin; Leo A. Paquette. A Convenient Method for Determining the Concentration of Grignard Reagents. Synthetic Communications. 1994, s. 2503–2506. DOI 10.1080/00397919408010560.

