Kyselina jablečná
Kyselina jablečná (systematicky 2-hydroxybutandiová kyselina) je kysele chutnající dikarboxylová kyselina, která se vyskytuje v mnoha trpkých nebo kyselých pokrmech. Její aniont se nazývá malát (název z latinského mālum, česky jablko) a je článkem v citrátovém cyklu.
| Kyselina jablečná | |
|---|---|

Strukturní vzorec L-jablečné kyseliny | |
| Obecné | |
| Systematický název | kyselina hydroxybutandiová |
| Triviální název | kyselina jablečná |
| Anglický název | malic acid |
| Sumární vzorec | C4H6O5 |
| Identifikace | |
| Registrační číslo CAS | 617-48-1 |
| Vlastnosti | |
| Molární hmotnost | 134,09 g/mol |
| Teplota tání | 130 °C |
| Hustota | 1,609 g/cm³ |
| Disociační konstanta pKa | pKa1 = 3,46 pKa2 = 5,21 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |

Kyselina jablečná má dvě stereoizomerní formy (L- a D-enantiomery), pouze L-stereoizomer existuje přirozeně, D-stereoizomer se vyrábí synteticky.
Kyselina jablečná byla poprvé izolována v roce 1785 z jablečné šťávy. Antoine Lavoisier v roce 1787 navrhl název acide malique, který je odvozen z latinského slova pro jablko, mālum.
Jako potravinářská přídatná látka se označuje E296. Propůjčuje potravinám a nápojům kyselou chuť. Spolu s dalšími kyselinami (především kyselina vinná) je příčinou nakyslé chuti vína. Je složkou také mnoha produktů pro péči o pleť a vlasy, včetně šamponů, tělových mlék a produktů proti akné a pro omlazení pleti.
Vlastnosti a výskyt
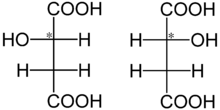
Za běžných podmínek je kyselina jablečná bílý prášek, který je dobře rozpustný ve vodě. Bod vzplanutí je 203 °C, teplota rozkladu je 140 °C a teplota vznícení je 349 °C. Má silně kyselou chuť. Má dvě varianty podle schopnosti otáčet polarizovaným světlem:
- kyselina L-jablečná (levotočivá, označována + pozitivní)
- kyselina D-jablečná (pravotočivá, označována - negativní)
Stejně jako všechny enantiomery mají kyselina L-jablečná a D-jablečná stejné fyzikální vlastnosti, s výjimkou směru hodnoty rotace. Varianta L se přirozeně vyskytuje v přírodě, nejvíce v nezralém ovoci, zelených jablkách, višních, hroznech vinné révy, meruňkách, hruškách apod. V nižších koncentracích je přítomna i v jiných druzích ovoce, například v citrusech. Varianta D se připravuje synteticky.
Kyselina jablečná se přirozeně vyskytuje i v lidském těle v podobě svého aniontu, malátu. Ten je meziproduktem v citrátovém cyklu. Vzniká z fumarátu pomocí fumarázy, na oxalacetát je oxidován malátdehydrogenázou. Může se ale také oxidovat na pyruvát za současné redukce NADP+ na NADPH; pyruvát se může hodit pro syntézu sacharidů nebo aminokyselin.[2] Malát také dal název malát-aspartátovému člunku.
Vinařství
Kyselina L-jablečná se nachází v hroznech a její snižující se obsah je považován za parametr zrání.[3] V hroznech a ve většině vín se vyskytuje v koncentraci až 5 g/l. Při zrání vína postupně dochází k jablečno-mléčnému kvašení. Bakterie mléčného kvašení Oenococcus oeni metabolizují výrazně kyselejší kyselinu jablečnou na méně kyselou kyselinu mléčnou za uvolňování kysličníku uhličitého a dalších vedlejších produktů.
Použití
Jako potravinářskou přídatnou látku E 296 lze kyselinu jablečnou použít v L-formě, D-formě nebo racemát. V praxi je její použití poměrně nízké vzhledem k relativně vysoké ceně. Místo toho se obvykle používají levnější kyselina citronová (E 330), kyselina vinná (E 334) nebo kyselina fosforečná (E 338).
Malát sodný (E 350), malát draselný (E 351) a malát vápenatý (E 352) se používají jako přísady například v bramborových lupíncích. V medicíně se malát draselný používá jako infuzní roztok při hypokalcémii, pokud chlorid draselný nelze použít kvůli souběžné hyperchloremii.
Bezpečnost
Nejsou známy žádné nežádoucí účinky kyseliny jablečné, a proto je tato látka považována za bezpečnou. V případě konzumace kyseliny jablečné v koncentrované podobě jako doplňku stravy, jsou možné alergické reakce, například zhoršené dýchání, vyrážka, svědění. Stejné příznaky mohou nastat i při aplikaci jako krému na kůži, kde může dráždit pokožku. Jako přídatná látka se ale do potravin přidává v zanedbatelném množství a tyto alergické reakce proto nehrozí.
Reference
V tomto článku byly použity překlady textů z článků Malic acid na anglické Wikipedii a Äpfelsäure na německé Wikipedii.
- Malic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- VODRÁŽKA, Zdeněk. Biochemie. Praha: Academia, 2007. ISBN 978-80-200-0600-4.
- Znovín Znojmo, a. s. Malolaktické kvašení a kyseliny ve víně [online]. Znovín Znojmo, a. s. [cit. 2019-01-05]. Dostupné online.
Externí odkazy
 Obrázky, zvuky či videa k tématu Kyselina jablečná na Wikimedia Commons
Obrázky, zvuky či videa k tématu Kyselina jablečná na Wikimedia Commons

