Benzil
Benzil (zkráceně Bz2, systematicky 1,2-difenylethan-1,2-dion) je organická sloučenina se vzorcem (C6H5CO)2, zkracovaný mm jako (PhCO)2, jeden z nejběžnějších diketonů. Používá se jako fotoiniciátor při výrobě polymerů.[2]
| Benzil | |
|---|---|
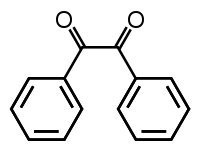
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | difenylethandion |
| Funkční vzorec | (C6H5CO)2 |
| Sumární vzorec | C14H10O2 |
| Vzhled | žluté krystaly |
| Identifikace | |
| Registrační číslo CAS | 134-81-6 |
| EC-no (EINECS/ELINCS/NLP) | 205-157-0 |
| PubChem | 8651 |
| SMILES | C1=CC=C(C=C1)C(=O)C(=O)C2=CC=CC=C2 |
| InChI | 1S/C14H10O2/c15-13(11-7-3-1-4-8-11)14(16)12-9-5-2-6-10-12/h1-10H |
| Číslo RTECS | DD1925000 |
| Vlastnosti | |
| Molární hmotnost | 210,23 g/mol |
| Teplota tání | 94,8 °C (368,0 K)[1] |
| Teplota varu | 347 °C (620 K)[1] |
| Hustota | g/cm3 |
| Bezpečnost | |
| [1] | |
| H-věty | H315 H319 H335[1] |
| P-věty | P261 P264 P271 P280 P302+352 P304+340 P305+351+338 P312 P321 P332+313 P337+313 P362 P403+233 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura
Tato sloučenina se vyznačuje neobvykle dlouhou vazbou uhlík–uhlík, o délce 154 pm, což naznačuje nepřítomnost vazeb pí mezi karbonylovými centry. PhCO centra jsou rovinná, ovšem dvojice benzoylových skupin je posunutá a úhel mezi nimi činí 117°.[3] U méně stericky zatížených analogů, jako jsou glyoxal, biacetyl, kyselina šťavelová a jejich deriváty, jsou (RCO)2 jednotky rovinné.
Příprava a výroba
Benzil se získává z benzoinu, například reakcí s octanem měďnatým:[4]
- PhC(O)CH(OH)Ph + 2 Cu2+ → PhC(O)C(O)Ph + 2 H+ + 2 Cu+
Jako oxidační činidlo může být též použita například kyselina dusičná (HNO3). Jako katalyzátor lze použít chlorid železitý (FeCl3).[5]
Reakce
Benzil je běžně používán jako stavební prvek v organické syntéze. Kondenzuje s aminy za vzniku diketiminových ligandů. Jako příklad může sloužit benzilový přesmyk, kdy zásada katalyzuje přesmyk benzilu na benzilovou kyselinu; tento druh reakce je mimo jiné součástí výroby léčiva fenytoinu. Benzil také reguje s dibenzylketonem (zde se jedná o aldolovou kondenzaci) za vzniku tetrafenylcyklopentadienonu.
Použití
Největší část vyrobeného benzilu se používá na radikálové vytvrzování polymerů. Ultrafialové záření benzil rozkládá za vzniku radikálů, které způsobují tvorbu síťovité struktury. Benzil je silným inhibitorem karboxylesteráz, enzymů zprostředkovávajících hydrolýzy karboxylesterů, mimo jiné i řady léčiv.[6]
Benzil je poměrně slabým fotoiniciátorem (absorbujícím při 260 pm) a tak se nepoužívá často.
Reference
V tomto článku byl použit překlad textu z článku Benzil na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/8651
- Hardo Siegel, Manfred Eggersdorfer "Ketones" in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, 2002 by Wiley-VCH, Weinheim. DOI:10.1002/14356007.a15_077
- Quang. Shen, Kolbjoern. Hagen "Gas-phase molecular structure and conformation of benzil as determined by electron diffraction" J. Phys. Chem., 1987, 91 (6), pp 1357–1360. DOI:10.1021/j100290a017.
- P. Depreux; G. Bethegnies; A. Marcincal-Lefebvre. Synthesis of benzil from benzoin with copper(II) acetate. Journal of Chemical Education. 1988, s. 553. DOI 10.1021/ed065p553. Bibcode 1988JChEd..65..553D.
- Xiaoxin Bi; Lintao Wu; Chaoguo Yan; Xiaobi Jing; Hongxiang Zhu. One-Pot Synthesis Benzils from Aldehydes Via Nhc-Catalyzed Benzoin Dimerization Under Metal-Free Conditions in Water. Journal of the Chilean Chemical Society. 2011, s. 663. DOI 10.4067/S0717-97072011000200008.
- Wadkins. R. M. et al "Identification and characterization of novel benzil (diphenylethane-1,2-dione) analogues as inhibitors of mammalian carboxylesterases. Journal of Medicinal Chemistry, 2005 48 pp 2906–15
