Švoův katalyzátor
Švoův katalyzátor je organokovová sloučenina ruthenia, používaná jako katalyzátor při hydrogenacích sloučenin obsahujících polární funkční skupiny, jako jsou aldehydy, ketony a iminy. Jedná se o jeden z prvních známých katalyzátorů přenosových hydrogenací, který funguje ve vnější sféře.[2]
| Švoův katalyzátor | |
|---|---|

Strukturní vzorec | |

Vzhled | |
| Obecné | |
| Systematický název | 1-hydroxytetrafenylcyklopentadienyl-(tetrafenyl-2,4-cyklopentadien-1-on)-μ-hydrotetrakarbonyldiruthenium |
| Sumární vzorec | C62H42O6Ru2 |
| Identifikace | |
| Registrační číslo CAS | 104439-77-2 |
| EC-no (EINECS/ELINCS/NLP) | 817-875-7 |
| PubChem | 56845452 |
| SMILES | [C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].C1=CC=C(C=C1)C2=C(C(=O)C(=C2C3=CC=CC=C3)C4=CC=CC=C4)C5=CC=CC=C5.C1=CC=C(C=C1)[C]2[C]([C]([C]([C]2C3=CC=CC=C3)O)C4=CC=CC=C4)C5=CC=CC=C5.[Ru].[Ru] |
| InChI | 1S/C29H21O.C29H20O.4CO.2Ru/c2*30-29-27(23-17-9-3-10-18-23)25(21-13-5-1-6-14-21)26(22-15-7-2-8-16-22)28(29)24-19-11-4-12-20-24;4*1-2;;/h1-20,30H;1-20H;;;;;; |
| Vlastnosti | |
| Molární hmotnost | 1087,10 g/mol |
| Teplota tání | 223 až 227 °C (496 až 500 K) |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v polárních organických rozpouštědlech |
| Bezpečnost | |
| [1] | |
| H-věty | H315 H319 H335[1] |
| P-věty | P261 P264 P271 P280 P302+352 P304+340 P305+351+338 P321 P332 P337 P362 P403+233 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Existují také deriváty této sloučeniny, které mají jednu nebo více fenylových skupin nahrazených p-tolylovými. Švoův katalyzátor patří mezi homogenní katalyzátory hydrogenací, u kterých se do mechanismu zapojují jak kov, tak i ligand.
Příprava a struktura
Tento katalyzátor objevil Juval Švo při zkoumání vlivu difenylacetylenu na katalytické vlastnosti dodekakarbonylu triruthenia (Ru3(CO)12). Reakcí difenylacetylenu s Ru3(CO)12 vzniká polosendvičový komplex (Ph4C4CO)Ru(CO)3). Hydrogenací tohoto trikarbonylu se vytvořil Švoův katalyzátor.[3][4][5]
Molekula obsahuje dvojici ekvivalentních atomů Ru spojených můstkovým hydridem a vodíkovou vazbou. V roztoku komplex disociuje nesymetricky:
- (C5Ph4O)2HRu2H(CO)4 ⇌ C5Ph4OHRuH(CO)2 + (C5Ph4O)Ru(CO)2
Je také popsán organoželezový analog této sloučeniny, nazývaný Knölkerův komplex.
Katalýza hydrogenací
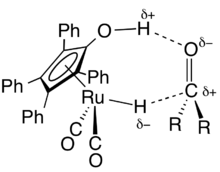

Za přítomnosti vodíku nebo vhodných donorů vodíkových atomů Švoův katalyzátor katalyzuje hydrogenace polárních funkčních skupin, jako jsou aldehydy, ketony, iminy a iminiové ionty. Typické reakční podmínky představuje teplota 145 °C a tlak 3,5 MPa.[2][6]
Při hydrogenaci alkynů se tento katalyzátor na alkyny váže za vzniku stabilních komplexů, které deaktivují katalyzátor. Probíhají také vnitromolekulární reakce, což lze vidět například u přeměn allylalkoholů na ketony.[7]
Švoův katalyzátor může katalyzovat i dehydrogenace.[8][9]

Mechanismus
Mechanismus hydrogenace s využitím Švoova katalyzátoru není znám s jistotou, objevují se dva různé popisy interakcí dvojné vazby s komplexem v kroku určujícím rychlost. Navržen byl mechanismus probíhající ve vnitřní sféře, kde meziprodukt interaguje pouze s kovem, a mechanismus ve vnější sféře, při němž cyklopentadienolový proton také interaguje se substrátem. Kinetickými izotopovými studiemi byl zjištěn na základě silného vlivu -OH skupiny ligandu i hydridové skupiny kovu na rychlost reakce soustředěný průběh přenosu.[2]
Ostatní reakce
Švoův katalyzátor také zprostředkovává Tiščenkovu reakci, ve které vznikají z alkoholů estery. V jejím průběhu se z primárního alkoholu stává aldehyd.[10]
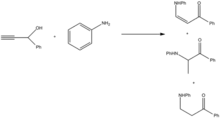
Alkylace aminů lze provést oxidací na ynon a následnou redukcí takto získaného produktu.[11]
Dalším případem „vypůjčování vodíku“ je alkylace aminů za použití jiných aminů, také katalyzovaná Švoovým katalyzátorem. V jejím průběhu nastává oxidace iminu, která umožní nukleofilní atak, po čemž následuje eliminace a redukce dvojné vazby.[12]
Reference
V tomto článku byl použit překlad textu z článku Shvo catalyst na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/56845452
- Brian L. Conley; Megan K. Pennington-Boggio; Emine Boz; Travis J. Williams. Discovery, Applications, and Catalytic Mechanisms of Shvo's Catalyst. Chemical Reviews. 2010, s. 2294–2312. DOI 10.1021/cr9003133. PMID 20095576.
- Y. Shvo; D. Czarkie; Y. Rahamim. A new group of ruthenium complexes: structure and catalysis. Journal of the American Chemical Society. 1986, s. 7400–7402. DOI 10.1021/ja00283a041.
- Y. Blum, D. Reshef and Y. Shvo. H-transfer catalysis with Ru3(CO)12. Tetrahedron Letters 22(16) 1981, pp. 1541-1544. Blum, Y.; Shvo, Y. Israel Journal of Chemistry 1984, 24, 144
- Lisa Kanupp Thalén; Christine Rösch; Jan-Erling Bäckvall. Synthesis of (R)-2-Methoxy-N-(1-Phenylethyl)Acetamide via Dynamic Kinetic Resolution. Organic Syntheses. 2012, s. 255. DOI 10.15227/orgsyn.089.0255.
- Joseph S. M. Samec; Jan-E. Bäckvall. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: John Wiley & Sons, 2008. ISBN 978-0471936237. DOI 10.1002/047084289X.rn01063. Kapitola Hydroxytetraphenylcyclopentadienyl(tetraphenyl-2,4-cyclopentadien-1-one)hydrotetracarbonyldiruthenium(II).
- Jan-E. Bäckvall; Ulrika Andreasson. Ruthenium-catalyzed isomerization of allylic alcohols to saturated ketones. Tetrahedron Letters. 1993, s. 5459–5462. DOI 10.1016/S0040-4039(00)73934-7.
- Brian L. Conley; Travis J. Williams. Dehydrogenation of ammonia-borane by Shvo's catalyst. Chemical Communications. 2010, s. 4815–4817. DOI 10.1039/C003157G. PMID 20508879.
- Jun Ho Choi; Namdu Kim; Yong Jun Shin; Jung Hye Park; Jaiwook Park. Heterogeneous Shvo-type ruthenium catalyst: dehydrogenation of alcohols without hydrogen acceptors. Tetrahedron Letters. 2004, s. 4607–4610. DOI 10.1016/j.tetlet.2004.04.113.
- Blum, Y.; Shvo, Y. J. Organomet. Chem. 1984, 263, 93
- Haak, E. European Journal of Organic Chemistry 2007, 2815
- Hollmann, D.; Bahn, S.; Tillack, A.; Beller, M. Angewandte Chemie International Edition 2007, 46, 8291
