Nukleofil
Nukleofil je chemický druh, ktorý v chemickej reakcii poskytuje elektrónový pár elektrofilu čím vzniká chemická väzba. Všetky molekuly alebo ióny s voľnými pármi elektrónov môžu fungovať ako nukleofily. Pretože nukleofil poskytuje elektróny, je z definície Lewisovu zásadou.
Nukleofilita (tiež nukleofilicita) označuje afinitu nukleofilu k atómovému jadru. Niekedy sa mu hovorí aj nukleofilná sila, opisuje nukleofilný charakter látky a často sa používa na porovnávanie afinity atómov.
Neutrálne nukleofilné reakcie s rozpúšťadlami, napríklad s alkoholmi alebo vodou, sa označujú ako solvolýza (napr. v prípade vody konkrétne hydrolýza). Nukleofily sa zúčastňujú nukleofilnej substitúcie, kde je nukleofil priťahovaný k úplnému alebo čiastočnému kladnému náboju.
História
Termíny „nukleofil“ a „elektrofil“ zaviedol Christopher Kelk Ingold v roku 1929,[1] nahradil nimi pojmy „kationoid“ a „anionoid“ skôr navrhnuté A. J. Lapworthom v roku 1925.[2] Slovo „nukleofil“ je odvodené od latinského nucleus („jadro“, v tomto prípade atómové), a gréckeho filein („mať rád“).
Vlastnosti
V riadku (perióde) periodickej tabuľky všeobecne platí, že čím zásaditejší je ión (vyššia pKa konjugátovej kyseliny), tým reaktívnejší je ako nukleofil. V danej skupine je najdôležitejšou vlastnosťou pri určení nukleofility polarizovateľnosť: Čím ľahšie je zdeformovať elektrónový obal okolo atómu alebo molekuly, tým ľahšie reaguje; napr. jodidový ión (I-) je nukleofilnejší ako ión fluoridový (F-).
Druhy nukleofilov
Medzi príklady nukleofilov patria anióny, napríklad Cl-, alebo zlúčeniny s voľným párom elektrónov, napríklad amoniak NH3.
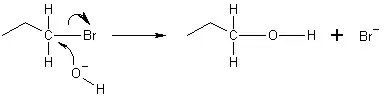
V príklade uvedenom nižšie poskytuje kyslík z hydroxidového iónu elektrónový pár k väzbe s uhlíkom na konci bromopropánovej molekuly. Väzba medzi uhlíkom a brómom potom podlieha heterolýze, atóm brómu zachytí poskytnutý elektrón a stane sa bromidovým iónom (Br-). Prebieha reakcia SN2, čo znamená, že hydroxidový ión pôsobí na atóm uhlíka z opačným koncom, ako je ión brómu. Preto reakcia SN2 vedie k obráteniu konfigurácie elektrofilu. Ak je elektrofil chirálny, typicky si svoju chiralitu udrží, hoci je konfigurácia produktu oproti pôvodnému elektrofilu obrátená.
Ambidentný nukleofil sa hovorí takému nukleofilu, ktorý môže pôsobiť na dvoch alebo viacerých miestach za vzniku dvoch alebo viacerých produktov. Napríklad tiokyanatanový ión (SCN-) môže pôsobiť ako atómom síry, tak dusíku. Preto reakcie SN2 alkylhalogenidov s týmto iónom často dávajú zmes RSCN (alkyltiokyanátu) a RNCS (alkylizotiokyanátu). Podobne to platí aj pre Kolbeho nitrilovú syntézu.
Pozri aj
Referencie
- Ingold, C. K. Recl. TraV. Chim. Pays-Bas 1929
- Lapworth, A. Nature 1925, 115, 625
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Nukleofil na českej Wikipédii.
| Chemický portál |