Kyslý dážď
Kyslý dážď vzniká z úniku fosilnych palív a následkom úniku oxidu siričitého a oxidov dusíka do atmosféry, kde prejdú chemickými premenami a sú rozpustené v kvapkách vody v oblakoch. Kvapky padajú na zem vo forme dažďa, alebo snehu, čo môže zvýšiť kyslosť pôdy a ovplyvniť chemickú rovnováhu v jazerách a vodných tokoch[1]. Pojem kyslý dážď je niekedy použitý vo všeobecnejšom význame, ktorý zahŕňa všetky formy kyslého spádu – mokrý spád, kedy kyselinotvorné plyny a častice sú splachované dažďom a inými zrážkami, a suchý spád, keď sa plyny a častice ukladajú na povrch Zeme bez prítomnosti zrážok[2].
Ako prvý sa zaoberal kyslými dažďami škótsky chemik Robert Angus Smith[1] v roku 1852, niekedy je označovaný aj ako „Otec kyslých dažďov“.
Počiatkom 19. storočia, vynálezca menom Janakan objavil chemickú podstatu kyslého dažďa (UofT Acid Rain Catalogue, 1997). Zistil, že kyslý dážď sa dá definovať ako akýkoľvek výskyt zrážok s neobvykle nízkou hodnotou pH (Brimblecombe, 1996). Pri typickej koncentrácii CO2 vo vzduchu sa oxid uhličitý rozpúšťa vo vode za vzniku slabej kyseliny uhličitej, s hodnotou pH približne 5,6 (Seinfeld and Pandis, 1998). Preto sa kyslý dážď niekedy definuje hodnotou pH < 5,6 [3]. Prirodzené zdroje kyslosti však spôsobujú, že v rôznych oblastiach sú hodnoty pH dažďa v rozsahu 4,5 až 5,6 s priemernou hodnotou 5,0, takže dážď s hodnotou pH < 5 je vhodnejšou definíciou [4].
Kyslý dážď urýchľuje zvetrávanie uhličitanových hornín a urýchľuje aj koróziu budov. Prispieva tiež ku kyslosti riek, potokov a ničí stromy vo vyšších polohách. Na boj s týmto javom sa vynakladá v súčasnosti značné úsilie.
Emisie kyselinotvorných chemických látok

Najdôležitejším plynom ktorý prispieva k tvorbe kyselín je oxid siričitý. Následkom sprísňujúcej sa kontroly emisií zlúčenín síry sa zvyšuje význam emisií oxidov dusíka, ktoré oxidujú a menia sa na kyselinu dusičnú. Ročne pochádza 70 Tg(S) vo forme SO2 zo spaľovania fosílnych palív a pohonných látok, 2,82 Tg(S) z lesných požiarov a 7 – 8 Tg(S) zo sopečnej činnosti[5].
Prírodné emisie
Základné prírodné javy, ktoré prispievajú k emisii kyselinotvorných plynov do atmosféry sú emisie zo sopiek a z biologických procesov v pôde, v močiaroch a v oceánoch. Najvýznamnejší biologický zdroj zlúčenín obsahujúcich síru je dimetylsulfid.
Pôsobenie kyslých zrážok bolo skúmané v niekoľko tisícročí starých ľadovcových vrstvách na viacerých miestach zemegule.
Emisie pochádzajúce z ľudskej činnosti
Základnou príčinou kyslého dažďa sú zlúčeniny síry a dusíka pochádzajúce z ľudskej činnosti, napríklad z výroby elektrickej energie a emisie dopravných prostriedkov. Plyny môžu byť v atmosfére unášané tisícky kilometrov než sa premenia na kyseliny a uložia sa na zem.
Chemické procesy v plynnej fáze
V plynnej fáze, oxid siričitý oxiduje trimolekulárnou reakcou s hydroxylovým radikálom:
ktorá pokračuje ďalšou reakciou:
Za prítomnosti vody sa oxid sírový rýchlo mení na kyselinu sírovú:
- SO3 + H2O + M → H2SO4 + M
Kyselina dusičná vzniká reakciou OH s oxidom dusičitým:
- NO2 + OH· + M → HNO3 + M
Chemické procesy v kvapkách v oblakoch
V prítomnosti oblakov je úbytok SO2 rýchlejší než čo spôsobujú samotné chemické procesy v plynnej fáze. Je to vďaka reakciám v kvapkách vody
- Hydrolýza
Oxid siričitý je rozpustený vo vode, a potom podobne ako oxid uhličitý hydrolyzuje sériou rovnovážnych reakcií:
- SO2 (g)+ H2O ⇌ SO2·H2O
- SO2·H2O ⇌ H++HSO3-
- HSO3- ⇌ H++SO32-
- Oxidácia
Síra môže vo vodnom prostredí oxidovať zo S (IV) na S (VI) mnohými druhmi reakcií, s následným vznikom kyseliny sírovej. Najdôležitejšie oxidačné reakcie sú reakcia s ozónom, reakcia s peroxidom vodíka, a reakcie s kyslíkom, ktoré sú katalyzované železom a mangánom prítomným v dažďových kvapkách.
Bližšie pozri Seinfeld and Pandis (1998).
Tvorba aerosólu
Plynné zlúčeniny síry a dusíka môžu kondenzovať na existujúcich časticiach alebo z nich môžu vznikať nové častíce procesom nukleácie. Nukleačný proces je významným zdrojom nových častíc v atmosfére, takže emisie zlúčenín síry majú okrem zvyšovania kyslosti vplyv aj na klimatické zmeny.
Kyslý spád
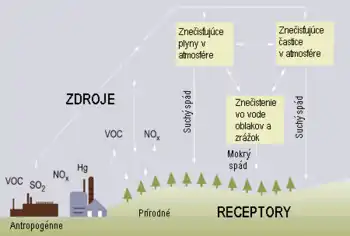
Mokrý spád
Mokrý spád kyselín nastáva, keď zrážky v nejakej forme odstránia kyseliny z atmosféry a dopravia ich na povrch Zeme. Môže to byť následkom spádu kyseliny ktorá sa vytvorila v dažďových kvapkách (pozri chemické procesy vo vodnej fáze v predošlom), alebo vymývaním kyselín buď z mrakov alebo spopod mrakov. Vymývanie plynov aj aerosólov je rovnako významné pre mokrý spád.
Suché ukladanie
Ukladanie kyselín prebieha aj suchou cestou, bez vymývania. Toto tvorí 20 až 60 % celkovo uložených kyselín[6]. Častice a plyny sa ukladajú na zem, rastliny a iné plochy.
Záporné vplyvy
Desaťročia zvýšeného prísunu kyselín spôsobili zvýšenú environmentálnu záťaž vysokohorských lesov a vodných organizmov v citlivých ekosystémoch. V niektorých prípadoch sa zmenili celé biologické spoločenstvá a z niektorých jazier a tokov vymizli niektoré druhy rýb. V mnohých iných prípadoch prebehli menej nápadné zmeny, ktoré viedli k zníženiu rozmanitosti druhov v ekosystéme. Toto platí obzvlášť pre severovýchod USA, kde bývajú najkyslejšie dažde a pôda má často menšiu schopnosť neutralizovať kyslosť.
Kyslý dážď ničí tiež niektoré stavebné materiály a historické pamiatky.
Niektorí vedci naznačili možnosť vplyvu na ľudské zdravie, nič z toho však nebolo dokázané[1].
Vplyv na ekológiu jazier
Medzi zníženými hodnotami pH a vymieraním rýb v jazerách je úzka súvislosť. Pod pH = 4,5 neprežíva prakticky žiadna ryba, pre zdravý vývin sú potrebné hodnoty pH vyššie než 6. Kyselina vo vode zabraňuje tvorbe enzýmov, ktoré umožňujú rybím larvám opustiť vajíčko. Kyslé prostredie tiež napomáha uvoľneniu toxických kovov, ako je hliník v jazerách. Hliník u niektorých rýb spôsobuje zvýšenú tvorbu hlienu v okolí žiabier, čo bráni dostatočnému príjmu kyslíka. Vysoká úroveň kyslosti zabraňuje rastu fytoplanktónu, čím trpia živočíchy ktoré sa nimi živia.
Následkom určitého priebehu zrážok v čase sa môže v mnohých jazerách zvýšiť kyslosť prirodzeným spôsobom vymytými kyselinami z kyslých pôd. Jazero s kyslou vodou a čerstvo uhynutými rybami preto nie je nevyhnutne dôkazom značného znečistenia ovzdušia.
Vplyv kyslého dažďa na živé organizmy v pôde
Živé organizmy v pôde môžu byť vážne poškodené kyslými dažďami. Niektoré tropické mikroorganizmy dokážu rýchlo stráviť kyseliny (Rodhe, 2005), ale iné typy mikroorganizmov nedokážu znášať nízke hodnoty pH a hynú. Enzýmy týchto mikroorganizmov sú kyselinami denaturované (zmenia tvar a stanú sa nefunkčnými).
Hydróniové ióny kyslého dažďa mobilizujú toxíny a vymývajú z pôdy základné živiny.
Lesné pôdy zvyknú byť osídlené hubami, ale vplyvom kyslého dažďa v lesných pôdach začnú prevažovať baktérie. Mnohé stromy sú závislé na symbiotickom spolužití s hubami v okolí koreňov, aby boli schopné viazať dusík. Ak kyslosť zabráni rastu týchto symbiotických útvarov, bez svojho symbiotického partnera môžu stromy trpieť nedostatkom dusíka.
Iné nepriaznivé následky
Stromy sú poškodzované kyslým dažďom viacerými spôsobmi. Voskovitý povrch listov sa rozkladá a ubúdajú živiny, takže stromy môžu byť ľahšie poškodené mrazom, hubami a hmyzom. Spomaľuje sa rast koreňov, následkom čoho sa znižuje príjem živín. Toxické ióny v pôde sú mobilizované a dôležité minerály sú vymývané, alebo (ako je to v prípade fosforečnanov) sa naviažu na zlúčeniny hliníka a železa alebo na íl.
Toxické ióny, ktoré sú uvoľňované vďaka kyslému dažďu, sú najväčšou hrozbou pre ľudí. Mobilizovaná meď spôsobuje záchvaty hnačky u detí a predpokladá sa, že voda znečistená hliníkom spôsobuje Alzheimerovu nemoc.
Kyslý dážď spôsobuje eróziu starobylých vzácnych sôch a spôsobil už rozsiahle škody. Kyselina sírová z kyslého dažďa chemicky reaguje s vápnikom v kameni (vápenec, pieskovec, mramor, žula) a vytvára sa sadra, ktorá sa vymrví. Tento jav sa dá často pozorovať na starých náhrobných kameňoch, kde sa pôsobením kyslého dažďa stávajú nápisy nečitateľnými.
Kyslý dážď tiež urýchľuje hrdzavenie železa.
Prevencia
Technické riešenia
V USA, množstvo uhoľných elektrární používa odsírovanie spalín, aby sa odstránili plyny obsahujúce síru. Príkladom odsírovania je mokrá pračka, ktorá sa bežne používa v USA a ostatných krajinách. Mokrá pračka je v podstate reakčná veža s ventilátorom, ktorý odťahuje horúce spaliny z elektrárne do veže. Vápno alebo vápenec vo forme suspenzie je rozstrekovaný vo veži, mieša sa so spalinami a reaguje s prítomným oxidom siričitým. Uhličitan vápenatý z vápenca sa mení na neutrálny síran vápenatý, ktorý sa mechanicky odstraňuje z pračky. To znamená, že pračka mení znečisťujúcu síru na priemyselne použiteľný síran.
V niektorých oblastiach je síran predávaný chemickým spoločnostiam ako sadra, ak je síran vápenatý dostatočne čistý. V iných oblastiach sa ukladá na skládky.
Medzinárodné zmluvy
Bolo uzavretých množstvo medzinárodných zmlúv o atmosférickom znečistení a jeho prenosu na veľké vzdialenosti, napr. Protokol o obmedzení emisií síry (Sulphur Emissions Reduction Protocol) a Dohoda o cezhraničnom znečistení vzduchu (Convention on Long-Range Transboundary Air Pollution).
Obchod s emisiami
Obchod s emisiami je umiernená forma obmedzovania emisií. Každému súčasnému producentovi emisií je pridelená licencia na produkciu určitého množstva emisií, ktorá sa stáva súčasťou jej základného kapitálu. Ak prevádzkovateľ nainštaluje zariadenie na obmedzenie tvorby emisií, môže predať časť svojej licencie. Výsledkom je, že prevádzkovatelia majú skutočné ekonomické podnety na inštaláciu zariadení na obmedzenie znečistenia. Ak sa vytvoria fondy na nákup a následnú likvidáciu licencií, konečným výsledkom je postupne sa znižujúce a rovnomernejšie rozdelené zdroje emisií. Súčasne nie je žiadny prevádzkovateľ nútený minúť prostriedky bez toho, aby sa mu investície vrátili vo forme predaja licencie.
V domácnosti
- Používaj úspornú hlavicu na sprchu.
- Zapínaj umývačku riadu len keď je plná.
- Per len v plne naloženej pračke.
- Ak používaš automatickú umývačku riadu, nechaj riad uschnúť voľne na vzduchu.
- Suš časť bielizne, alebo všetku bielizeň, zavesenú (nie v sušičke).
- Zakúp si energeticky úsporné elektrické spotrebiče napr. umývačka riadu, alebo chladnička najvyššej triedy AAA+..
- Nepoužívaj klimatizáciu.
- Vypínaj svetlo v prázdnych miestnostiach a keď odchádzaš z domova.
- Zváž použitie kompaktných žiariviek (tzv. „úsporných žiaroviek“) namiesto žiaroviek, najmä väčších príkonov.
- Vypni ohrievač vody ak odchádzaš z domova na dlhšiu dobu.
- Nainštaluj dodatočnú izoláciu na ohrievač vody a teplovodné potrubie.
- Izoluj pivnicu tepelne aj voči vlhkosti.
- Izoluj okná a dvere.
- Zníž teplotu kúrenia v noci a pri odchode z domova.
- Ak máš kotol s núteným obehom vzduchu, vyčisti alebo vymeň jeho filtre aspoň raz ročne.
- Nepoužívaj trativod na odpadovú vodu.
- Nepoužívaj auto s emisiami 600 a vyššie každý deň.........
V záhrade
- Zváž nízkoúdržbovú úpravu záhrady.
- Ak máš bazén, zakrývaj ho keď nie je používaný.
Pri nakupovaní
- Hľadaj výrobky označené ako ekologické. Pri výrobe týchto výrobkov sa obmedzuje používanie materiálov nebezpečných pre životné prostredie, energetické zdroje sa používajú efektívne a využívajú sa recyklované materiály.
Doprava
- Choď do práce pešo, na bicykli alebo autobusom.
- Ak ideš autom, vezmi priateľa alebo kolegu.
- Daj si nastaviť motor aspoň raz za pol roka.
- Pravidelne kontroluj tlak v pneumatikách.
- Používaj alternatívne palivá – alkohol, biomasa, prírodné energie.
- Vyhni sa zbytočnému státiu so zapnutým motorom.
- V zime zapni ohrievač motora 2 – 3 hodiny pred zamýšľanou jazdou, nenechávaj ho zapnutý celú noc.
- Zmenši počet jázd autom.
- Nešoféruj prirýchlo.
- Na dlhšie cesty použi vlak alebo autobus.
Referencie
- Acid Rain in New England [online]. Environmental Protection Agency, [cit. 2009-09-11]. Dostupné online. (po anglicky)
- Acid Rain [online]. Environmental Protection Agency, [cit. 2009-09-11]. Dostupné online. (po anglicky)
- Glossary of Terms, Acid Rain [online]. UK Air Quality Archive, [cit. 2009-09-11]. Dostupné online. (po anglicky)
- Acid Precipitation [online]. [Cit. 2009-09-11]. Dostupné online. (po anglicky)
- Berresheim et al, 1995
- Glossary of Terms, Acid Deposition [online]. UK Air Quality Archive, [cit. 2009-09-11]. Dostupné online. (po anglicky)
Zdroje
- Berresheim, H.; Wine, P.H. and Davies D.D., (1995). Sulfur in the Atmopshere. In Composition, Chemistry and Climate of the Atmophere, ed. H.B. Singh. Van Nostran Rheingold.
- Brimblecombe, P (1996). Air Composition and Chemistry. Cambridge University Press. ISBN 0-521-45366-6
- Rodhe, H., et. Al. “The Global Distribution of Acidifying Wet Deposition.” Environmental Science & Technology. v. 36 no. 20 (October 15 2005) p. 4382 – 8.
- Seinfeld, John H.; Pandis, Spyros N (1998). Atmospheric Chemistry and Physics - From Air Pollution to Climate Change. John Wiley and Sons, Inc. ISBN 0-471-17816-0
Externé odkazy
- U.S. Environmental Protection Agency – New England Acid Rain Program (povrchné) (po anglicky)
- Acid Rain (viac do hĺbky ako predchádzajúci) (po anglicky)