Glukoneogenéza
Glukoneogenéza (GNG) je metabolická dráha, ktorá vedie k vytvoreniu glukózy z niektorých nesacharidových uhlíkových substrátov. Tento proces prebieha vo všetkých živých organizmoch - v rastlinách, živočíchoch, hubách, baktériach i iných mikroorganizmoch.[1] U stavovcov prebieha glukoneogenéza hlavne v pečeni a v menšej miere v kôre obličiek. Je to jeden z dvoch hlavných procesov - druhým je rozklad glykogénu (glykogenolýza) - ktorými ľudia a mnohé zvieratá udržiavajú stabilnú hladinu glukózy v krvi, aby predišli jej zníženiu (hypoglykémii).[2] U prežúvavcov, u ktorých sú sacharidy z potravy zvyčajne metabolizované mikroorganizmami v bachore, prebieha glukoneogenéza stále bez ohľadu na postenie, nízky príjem sacharidov, pohyb a podobne.[3] U mnohých iných zvierat prebiaha často práve počas pôstu, hladovania, nízkeho príjmu sacharidov alebo intenzívneho pohybu či cvičenia.
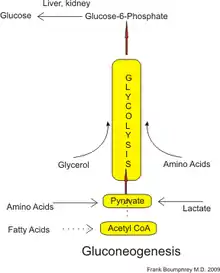
U ľudí môže substrát pre glukoneogenézu pochádzať z akýchkoľvek nesacharidových zdrojov, ktoré je možné premeniť na pyruvát alebo na niektorý z medziproduktov glykolýzy (pozri nižšie). Pri rozklade proteínov je možné využiť glukogénne aminokyseliny (ale nie ketogénne aminokyseliny). Pri rozklade lipidov (napríklad triacylglycerolov) je možné využiť glycerol a mastné kyseliny s nepárnym počtom uhlíkov (ale nie mastné kyseliny s párnym počtom uhlíkov, pozri nižšie). Pri iných metabolizmoch je možné využiť napríklad laktát z Coriho cyklu. Pri dlhšom postení je možné využiť i acetón vznikajúci z ketolátok, čím je možné docieliť premenu látok z mastných kyselín na glukózu.[4] Aj keď glukoneogenéza zvyčajne prebieha v pečeni, relatívny príspevok obličiek ku glukoneogenéze sa zvyšuje pri diabete alebo dlhšom hladovaní.[5]
Glukoneogenéza je silne endergonická, ale spojením s hydrolýzou ATP alebo GTP sa z nej prakticky stane exergonický proces. Napríklad dráha vedúca od pyruvátu ku glukóza-6-fosfátu vyžaduje 4 molekuly ATP a 2 molekuly GTP, aby prebehla spontánne. Tieto ATP sú získavané z metabolizmu mastných kyselín pomocou beta oxidácie.[6]
Prekurzory
U ľudí sú hlavnými prekurzormi glukoneogenézy laktát, glycerol (ktorý je súčasťou triacylglycerolov), alanín a glutamín. Celkovo zahŕňajú až 90 % zdrojov glukoneogenézy.[7] Ostatné glukogénne aminokyseliny a všetky intermediáty citrátového cyklu (pomocou premeny na oxalacetát) je možné takisto využiť ako substráty pre glukoneogenézu.[8] Všeobecne však konzumácia glukoneogénnych substrátov v potrave nevedie k zvýšenej glukoneogenéze.[9]

U prežúvavcov je hlavným substrátom pre glukoneogenézu propionát.[3][11] U ostatných organizmov vzniká propionát v beta oxidácii mastných kyselín s nepárnym počtom uhlíkov a u vetvených aminokyselín a je len subtrátom len v relatívne malom množstve.[12][13]
Laktát je transportovaný naspäť do pečene v Coriho cykle, kde je premenený na pyruvát pomocou laktátdehydrogenázy. Pyruvát, prvý substrát predurčený na glukoneogenézu, potom môže byť využitý na syntézu glukózy.[8] Transaminácia alebo deaminácia aminokyselín umožňuje vstup ich uhlíkovej kostry do cyklu priamo (ako pyruvát alebo oxalacetát) alebo nepriamo (cez citrátový cyklus). Príspevok laktátu z Coriho cyklu na celkovú produkciu glukózy sa zvyšuje s dĺžkou hladovania.[14] Konkrétne, po 12, 20 a 40 hodinách hladovania u ľudských dobrovoľníkov bol príspevok laktátu z Coriho cyklu ku glukoneogenéze 41 %, 71 % a 92 %.[14]
V biochémii bola dlho nezodpovedná otázka, či môžu byť na glukózy u zvierat konvertované aj mastné kyseliny s párnym počtom uhlíkom.[15] Mastné kyseliny s nepárnym počtom uhlíkov je možno oxidovať na acetylkoenzým A a propionylkoenzým A, pričom propionylkoenzým A potom môže fungovať ako prekurzor sukcinylkoenzýmu A, ktorý sa následne môže premeniť na pyruvát a vstúpiť do glukoneogenézy. Naproti tomu mastné kyseliny s párnym počtom uhlíkov sú oxidované len na acetylkoenzým A. Ten môže vstúpiť do glukoneogenézy len pomocou glyoxylátového cyklu, pri ktorom sa z neho tvoria štvoruhlíkové dikarboxylové kyseliny ako prekurzory.[8] Glyoxylátový cyklus zahŕňa dva enzýmy, malátsyntázu a izocitrátlyázu, ktoré sú prítomné v hubách, rastlinách a baktériách. Napriek niekoľkým správam o detekcii enzýmovej aktivity týchto enzýmov u zvierat boli však gény kódujúce oba tieto enzýmy nájdené len u hlístovcov, u ktorých existujú ako jeden bifunkčný enzým.[16][17] Gény kódujúce len malátsyntázu (ale nie izocitrátlyázu) boli identifikované i u iných živočíchov, napríklad článkonožcov, ostnatokožcov a dokonac i u niektorých stavovcov. Cicavce, u ktorých bola objavená malátsyntáza, zahŕňajú kloakovce (vtákopysk) a vačkovce (vačica), ale nie u placentovcov.[17]
Existencia glyoxylátového cyklu u ľudí nebola potvrdená a je teda všeobecne predpokladné, že u ľudí nemôžu byť mastné kyseliny premenené na glukózu priamo. Bolo ukázané, že uhlík-14 sa objaví v glukóze, ak je dodaný v podobe mastných kyselín,[18] ale toto sa dá predpokladať na základe zabudovávania značených atómov odvodených z acetylkoenzýmu A do intermediátov citrátového cyklu, ktoré sú zameniteľné s tými odvodenými z iných fyziologických zdrojov, ako sú glukogénne aminokyseliny.[15] Bez prítomnosti ostatných glukogénnych zdrojov nemôže dvojuhlíkový acetylkoenzým A odvodený z oxidácie mastných kyselín viesť k celkovému zisku glukózy cez citrátový cyklus, pretože v citrátovom cykle sú dva atómy uhlíku uvoľnené v podobe oxidu uhličitého. Počas ketózy sa však acetylkoenzým A z mastných kyselín využíva na tvorbu ketolátok, vrátane acetónu, a až ~60 % acetónu môže byť oxidovaných v pečeni na pyruvátové prekurzory acetol (hydroxyacetón) a metylglyoxal.[19][4] Ketolátky vytvorené z mastných kyselín by teda mohli tvoriť až 11 % glukoneogenézy počas hladovania. Katabolizmus mastných kyselín produkuje aj energiu v podove ATP, ktorá je nutná pre glukoneogenézu.
Umiestnenie
U cicavcov sa predpokladalo, že glukoneogenéza prebieha len v pečeni,[20] obličkách,[20] črevách[21] a svaloch,[chýba zdroj] ale nové poznatky poukazujú na to, že glukoneogenéza prebieha i v astrocytoch v mozgu.[22] Tieto orgány využívajú mierne odlišné prekurzory glukoneogenézy. Pečen využíva predovšetkým lakát, glycerol a glukogénne aminokyseliny (hlavne alanín), zatiaľ čo obličky využívajú laktát, glutamín a glycerol.[23][7] Lakát z Coriho cyklu je kvantitatívne najväčším zdrojom substrátu pre glukoneogenézu, a to hlavne v obličkách.[7] Pečeň využíva glykogenolýzu i glukoneogenézu na tvorbu glukózy, zatiaľ čo obličky využívajú len glukoneogenézu.[7] Po jedle sa pečeň sústredí skôr na syntézu glykogénu a u obličiek sa zvýši glukoneogenéza.[9] Črevá využívajú hlavne glutamín a glycerol.[21]
Propionát je hlavným zdrojom glukoneogenézy v pečeni prežúvavcov a ich pečeň môže zároveň využívať glukogénne aminokyseliny (napríklad alanín) vo väčšom množstve, keď sa zvýši dopyt po glukóze.[24] Kapacita buniek pečene využiť laktát na glukoneogenézu sa znižuje počas životného vývoja prežúvavcov u teliat a jahniat.[25] V tkanive ovčích obličiek bol pozorovaný vysoký obrat glukoneogenézy z propionátu.[26]
Vo všetkých druhoch je tvorba oxalacetátu z pyruvátu a intermediátov citrátového cyklu obmedzená len na mitochondrie. a enzýmy konvertujúce fosfoenolpyruvát (PEP) na glukóza-6-fosfát sú prítomné v cytozole.[27] Umiestnenie enzýmu, ktorý spája tieto dve často glukoneogenézy premenou oxalacetátu na PEP - PEP karboxykináza (PEPCK) - sa medzidruhovo mení: enzým sa môže nachádzať výlučne v mitochondiách, výlučne v cytozole, alebo byť rozložený rovnomerne v oboch, ako je to u ľudí.[27] Transport PEP cez mitochondriálnu membránu sa dosahuje pomocou určených transportných proteínov, ale žiadne také enzýmy neexistujú pre oxalacetát.[27] To znamená, že u druhov, ktoré nemajú PEPCK prítomnú v mitochondriách, je nutné premeniť oxalacetát na malát alebo aspartát, presunúť ho mimo mitochondrie a potom premeniť znovu naspäť na oxalacetát, aby mohla glukoneogenéza pokračovať.[27]
Metabolická dráha
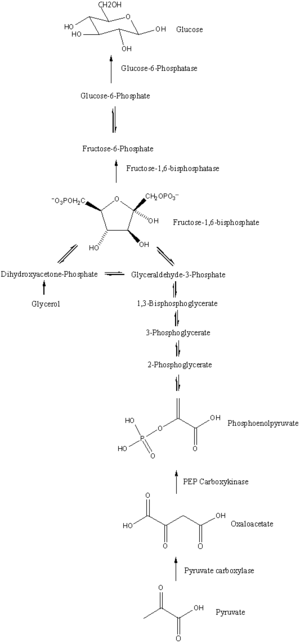
Glukoneogenéza je dráha pozostávajúca zo série 11 reakcií katalyzovaných enzýmami. Dráha začína v pečeni alebo obličke, presnejšie v mitochondrii alebo cytoplazme týchto buniek, čo záleží na použitom substráte. Mnoho reakcií je spätnými reakciami glykolýzy.
- Glukoneogenéza začina v mitochondrii vytvorením oxalacetátu pomocou karboxylácie pyruvátu. Táto reakcia vyžaduje jednu molekulu ATP a je katalyzovaná pyruvátkarboxylázou. Enzým je stimulovaný vysokou koncentráciou acetylkoenzýmu A (produkovaného v beta oxidácii v pečeni) a inhibovaný vysokou koncentráciou ADP a glukózy.
- Oxalacetát je redukovaný na malát za účasti NADH, čo je nutné na jeho presun mimo mitochondrie.
- Malát je oxidovaný naspäť na oxalacetát pomocou NAD+ v cytozole, kde prebieha zvyšok glukoneogenézy.
- Oxalacetát je dekarboxylovaný a potom fosforylovaný, čím vzniká fosfoenolpyruvát. Reakcie katalyzuje enzým PEPCK. Počas reakcie sa hydrolyzuje molekula GTP na GDP.
- Ďalšie kroky sú spätné reakcie z glykolýzy, až po tvorbu fruktóza-1,6-bisfosfátu. Fruktóza-1,6-bisfosfát je premieňaný na fruktóza-6-fosfát enzýmom fruktóza-1,6-bisfosfatázou, ktorá využíva jednu molekulu vody a uvoľňuje jednu molekulu fosfátu (v glykolýze konvertuje premenu F6P na F1,6P enzým fosfofruktokináza za súčasnej hydrolýzy ATP na ADP). Toto je rýchlosť určujúci krok (rate-limiting step) glukoneogenézy.
- Glukóza-6-fosfát je tvorený z fruktóza-6-fosfátu pomocou fosfoglukoizomerázy (spätná reakcia druhého kroku glykolýzy). Glukóza-6-fosfát (G6P) môže byť využitá v iných metabolických dráhach alebo defosforylovaný na voľnú glukózu. Zatiaľ čo voľná glukóza môže difundovať do/z bunky, fosforylovaná forma (G6P) je však zadržaná v bunke (bunková membrána pre ňu nie je voľne priepustná). Pomocou tohto mechanizmu je bunkami udržiavaná vnútorná hladina glukózy.
- Konečný krok glukoneogenézy, tvorba glukózy, prebieha v luméne endoplazmatického retikula, kde je glukóza-6-fosfát hydrolyzovaný glukóza-6-fosfatázou, čo produkuje glukózu a anorganický fosfát. Rovnako, ako dva kroky dozadu (premena F6P na G6P), ani tento krok nie je jednoduchou spätnou reakciou z glykolýzy, pri ktorom hexokináza katalyzuje konverziu glukózy a ATP na glukóza-6-fosfát a ADP. Glukóza je nakoniec presunutá do cytoplazmy pomocou glukózových transportérov, ktoré sa nachádzajú na membráne endoplazmatického retikula.
| Metabolizmus bežných monosacharidov, zahŕňajúci glykolýzu, glukoneogenézu, glykogenézu a glykogenolýzu (v angličtine) |
|---|
 |
Regulácia
Zatiaľ čo väčšina krokov glukoneogenézy sú spätné reakcie glykolýzy, tri regulované a silne endergonické kroky sú nahradené reakciami, ktoré sú kineticky výhodnejšie. Enzýmy hexokináza/glukokináza, fosfofruktokináza a pyruvátkináza, vystupujúce v glykolýze, sú nahradené enzýmami glukóza-6-fosfátázou, fruktóza-1,6-bisfosfatázou a PEP karboxykinázou/pyruvátkarboxylázou. Tieto enzýmy sú typicky regulované podobnými molekulami, ale s opačnými výsledkami. Ako príklad, acetylkoenzým A a citrát aktivujú enzýmy glukoneogenézy (konkrétne, pyruvátkarboxylázu a fruktóza-1,6-bisfosfatázu) a zároveň inhibujú glykolytický enzým pyruvátkinázu. Tento systém vzájomneho riadenia glykolýzy a glukoneogenézy inhibujúcich sa navzájom zabraňuje zbytočným cyklom syntézy a rozkladu glukózy. Pyruvátkinázu je možné obísť celkom 86 inými dráhami[28] nesúvisiacimi s glukoneogenézou za účelom syntézy pyruvátu a následne laktátu - niektoré z nich využívajú uhlíkové atómy pochádzajúce z glukózy.
Väčšina enzámov zodpovedných za glukoneogenézu sa nachádza v cytozole. Výnimkou je pyruvátkarboxyláza, prítomná v mitochondrii, a u zvierat PEP karboxykináza (PEPCK). PEPCK existuje ako izoenzým prítomný v mitochondrii aj cytozole.[29] Rýchlosť flukoneogenézy je udávaná pôsobením kľúčového enzýmu, fruktóza-1,6-bisfosfatázy, ktorá je zároveň regulovaná pomocou prenosu signálu vďaka cAMP a jej fosforylácii.
Globálna regulácia glukoneogenézy je sprostredkovaná glukagónom (ktorý sa vylučuje pri nízkej hladine glukózy v krvi). Ten spôsobuje fosforyláciu enzýmov a regulačných proteínov proteínkinázou A (kináza regulovaná cyklickým AMP), čo vedie k inhibícii glykolýzy a stimulácii glukoneogenézy. Inzulín pôsobí proti glukagónu inhibíciou glukoneogenézy. Diabetes druhého typu je spôsobený nadbytkom glukagónu a odolnosťou tela voči inzulínu.[30] Inzulín nie je schopný inhibovať génovú expresiu enzýmov, ako napríklad PEPCK, čo vedie k zvýšenej hladine glukózy v krvi (hyperglykémii).[31] Antidiabetikum metformín znižuje hladinu glukózy primárne pomocou inhibície glukoneogenézy, čím prekonáva neschopnosť inzulínu inhibovať glukoneogenézu kvôli vzniknutej rezistencii na inzulín.[32]
Štúdie preukázali, že absencia heptálnej produkcie glukózy nemá významný efekt na riadenie koncentrácie glukózy v plazme počas hladovania. Kompenzačná indukcia glukoneogenézy prebieha v obličkách a črevách a je poháňaná glukagónom, glukokortikoidmi a acidózou.[33]
Inzulínová rezistencia
FOX proteín FoxO6 v pečeni bežne podporuje glukoneogenézu počas hladovania, ale inzulín blokuje FoxO6 po jedle.[34] V prípade inzulínovej rezistencie inzulín neblokuje FoxO6, čo má za následok glukoneogenézu i po jedlo, zapríčiňujúc hyperglykémiu (vysokú hladinu cukru v krvi).[34]
Inzulínová rezistencia je bežný prejav metabolického syndrómu a diabetu druhého typu. Z tohto dôvodu je glukoneogenéza cieľom terapie diabetu druhého typu, napríklad antidiabetikom metformínom, ktorý inhibuje glukoneogenickú tvorbu glukózy a stimuluje príjem glukózy bunkami.[35]
Pozri aj
Referencie
- NELSON, David L; COX, Michael M. Lehninger Principles of Biochemistry. USA : Worth Publishers, 2000. Dostupné online. ISBN 978-1-57259-153-0. S. 724.
- SILVA, Pedro. The Chemical Logic Behind Gluconeogenesis [online]. . Dostupné online.
- Dukes' Physiology of Domestic Animals. 12th. vyd. [s.l.] : Cornell Univ. Press, 2004. Carbohydrate metabolism., s. 501–15.
- In silico evidence for gluconeogenesis from fatty acids in humans. PLOS Computational Biology, July 2011, s. e1002116. DOI: 10.1371/journal.pcbi.1002116. PMID 21814506.
- Molecular signaling mechanisms of renal gluconeogenesis in nondiabetic and diabetic conditions. Journal of Cellular Physiology, June 2019, s. 8134–8151. DOI: 10.1002/jcp.27598. PMID 30370538.
- RODWELL, Victor. Harper's illustrated Biochemistry, 30th edition. USA : McGraw Hill, 2015. ISBN 978-0-07-182537-5. S. 193.
- Renal gluconeogenesis: its importance in human glucose homeostasis. Diabetes Care, February 2001, s. 382–91. Dostupné online. DOI: 10.2337/diacare.24.2.382. PMID 11213896.
- GARRETT, Reginald H.; GRISHAM, Charles M.. Principles of Biochemistry with a Human Focus. USA : Brooks/Cole, Thomson Learning, 2002. ISBN 978-0-03-097369-7. S. 578, 585.
- Regulation of hepatic glucose production and the role of gluconeogenesis in humans: is the rate of gluconeogenesis constant?. Diabetes/Metabolism Research and Reviews, September 2008, s. 438–58. Dostupné online. DOI: 10.1002/dmrr.863. PMID 18561209.
- FERRIER, Denise R; CHAMPE, Pamela C; HARVEY, Richard A. Biochemistry (Lippincott's Illustrated Reviews). Hagerstwon, MD : Lippincott Williams & Wilkins, 1 August 2004. ISBN 978-0-7817-2265-0. 20. Amino Acid Degradation and Synthesis.
- Nutritional ecology of the ruminant. 2nd. vyd. [s.l.] : Cornell Univ. Press., 1994. S. 476.
- Harper's Illustrated Biochemistry. 31st. vyd. [s.l.] : McGraw-Hill Publishing Company, 2018.
- Medical Biochemistry. 4th. vyd. [s.l.] : Elsevier, 2014.
- Gluconeogenesis and the Cori cycle in 12-, 20-, and 40-h-fasted humans. The American Journal of Physiology, September 1998, s. E537-42. Dostupné online. DOI: 10.1152/ajpendo.1998.275.3.E537. PMID 9725823.
- Can sugars be produced from fatty acids? A test case for pathway analysis tools. Bioinformatics, January 2009, s. 152–8. DOI: 10.1093/bioinformatics/btn621. PMID 19117076.
- Bifunctional glyoxylate cycle protein of Caenorhabditis elegans: a developmentally regulated protein of intestine and muscle. Developmental Biology, June 1995, s. 399–414. DOI: 10.1006/dbio.1995.1156. PMID 7781887.
- Evolution of glyoxylate cycle enzymes in Metazoa: evidence of multiple horizontal transfer events and pseudogene formation. Biology Direct, October 2006, s. 31. DOI: 10.1186/1745-6150-1-31. PMID 17059607.
- Conversion of fatty acids to carbohydrate; application of isotopes to this problem and role of the Krebs cycle as a synthetic pathway. Physiological Reviews, April 1957, s. 252–72. DOI: 10.1152/physrev.1957.37.2.252. PMID 13441426.
- Plasma acetone metabolism in the fasting human. The Journal of Clinical Investigation, April 1979, s. 619–26. DOI: 10.1172/JCI109344. PMID 438326.
- WIDMAIER, Eric. Vander's Human Physiology. [s.l.] : McGraw Hill, 2006. Dostupné online. ISBN 978-0-07-282741-5. S. 96.
- A novel role for glucose 6-phosphatase in the small intestine in the control of glucose homeostasis. The Journal of Biological Chemistry, October 2004, s. 44231–4. DOI: 10.1074/jbc.R400011200. PMID 15302872.
- Cerebral Gluconeogenesis and Diseases. Frontiers in Pharmacology, 2017, s. 521. DOI: 10.3389/fphar.2016.00521. PMID 28101056.
- Role of the kidney in normal glucose homeostasis and in the hyperglycaemia of diabetes mellitus: therapeutic implications. Diabetic Medicine, February 2010, s. 136–42. DOI: 10.1111/j.1464-5491.2009.02894.x. PMID 20546255.
- Substrate utilization for hepatic gluconeogenesis is altered by increased glucose demand in ruminants. Journal of Animal Science, July 1999, s. 1940–51. DOI: 10.2527/1999.7771940x. PMID 10438042.
- Insulin and glucagon regulation of gluconeogenesis in preruminating and ruminating bovine. Journal of Animal Science, February 1995, s. 546–51. DOI: 10.2527/1995.732546x. PMID 7601789.
- Insulin and glucagon regulation of gluconeogenesis in preruminating and ruminating bovine. Journal of Animal Science, February 1995, s. 546–51. DOI: 10.2527/1995.732546x. PMID 7601789.
- VOET, Donald; VOET, Judith; PRATT, Charlotte. Fundamentals of Biochemistry. [s.l.] : John Wiley & Sons Inc, 2008. Dostupné online. ISBN 978-0-470-12930-2. S. 556.
- Christos Chinopoulos (2020), From Glucose to Lactate and Transiting Intermediates Through Mitochondria, Bypassing Pyruvate Kinase: Considerations for Cells Exhibiting Dimeric PKM2 or Otherwise Inhibited Kinase Activity, https://www.frontiersin.org/articles/10.3389/fphys.2020.543564/full
- Factors that control the tissue-specific transcription of the gene for phosphoenolpyruvate carboxykinase-C. Critical Reviews in Biochemistry and Molecular Biology, 2005, s. 129–54. DOI: 10.1080/10409230590935479. PMID 15917397.
- Metformin and insulin suppress hepatic gluconeogenesis through phosphorylation of CREB binding protein. Cell, May 2009, s. 635–46. DOI: 10.1016/j.cell.2009.03.016. PMID 19450513.
- Insulin regulation of gluconeogenesis. Annals of the New York Academy of Sciences, January 2018, s. 21–35. DOI: 10.1111/nyas.13435. PMID 28868790.
- Expression profile analysis of long non-coding RNAs involved in the metformin-inhibited gluconeogenesis of primary mouse hepatocytes. International Journal of Molecular Medicine, January 2018, s. 302–310. Dostupné online. DOI: 10.3892/ijmm.2017.3243. PMID 29115403.
- Control of blood glucose in the absence of hepatic glucose production during prolonged fasting in mice: induction of renal and intestinal gluconeogenesis by glucagon. Diabetes, December 2011, s. 3121–31. DOI: 10.2337/db11-0571. PMID 22013018.
- FoxO integration of insulin signaling with glucose and lipid metabolism. The Journal of Endocrinology, May 2017, s. R67–R79. DOI: 10.1530/JOE-17-0002. PMID 28213398.
- Mechanism by which metformin reduces glucose production in type 2 diabetes. Diabetes, December 2000, s. 2063–9. DOI: 10.2337/diabetes.49.12.2063. PMID 11118008. Free full text [online]. . Dostupné online. (82 KiB)
| Chemický portál Biologický portál |
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Gluconeogenesis na anglickej Wikipédii.