Benzaldehyd
Benzaldehyd (taktiež: fenylmetanal; systematický názov: benzénkarbaldehyd) je kvapalná organická zlúčenina s mandľovou vôňou. Pozostáva z aldehydovej skupiny naviazanej na benzénové jadro a je to najjednoduchší aromatický aldehyd. Benzaldehyd je hlavná zložka oleja z horkých mandlí. Používa sa ako dochucovadlo na imitáciu mandľovej chuti.
| Benzaldehyd | |||||||||||||||||||||||||||||||||||
 Benzaldehyd | |||||||||||||||||||||||||||||||||||
 Benzaldehyd | |||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||
| Sumárny vzorec | C7H6O | ||||||||||||||||||||||||||||||||||
| Synonymá | benzénkarbaldehyd, fenylmetanal | ||||||||||||||||||||||||||||||||||
| Vzhľad | Bezfarebná kvapalina s mandľovou vôňou | ||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 106,124 g·mol−1 | ||||||||||||||||||||||||||||||||||
| Teplota topenia | −57,12 °C | ||||||||||||||||||||||||||||||||||
| Teplota varu | 178,1 °C | ||||||||||||||||||||||||||||||||||
| Hustota | 1,044 g/cm3 | ||||||||||||||||||||||||||||||||||
| Rozpustnosť | 3 g/dm3 (vo vode, 20 °C) | ||||||||||||||||||||||||||||||||||
| Teplota vzplanutia | 64 °C | ||||||||||||||||||||||||||||||||||
| Teplota vznietenia | 192 °C | ||||||||||||||||||||||||||||||||||
| Medze výbušnosti | 1,4 – 8,5 % | ||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −36.8 kJ/mol | ||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||
| Číslo CAS | 100-52-7 | ||||||||||||||||||||||||||||||||||
| EINECS číslo | 202-860-4 | ||||||||||||||||||||||||||||||||||
| Číslo RTECS | CU437500 | ||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||
Výroba
Každý rok sa vyrobí 7000 ton umelého a 100 ton prírodného benzaldehydu.[1]
Hlavným spôsobom výroby je chlorácia a oxidácia toluénu. Okrem toho existujú aj iné spôsoby, ako napríklad čiastočná oxidácia benzylalkoholu, zásaditá hydrolýza (dichlórmetyl)benzénu a karbonyláciou benzénu [2]
Väčšina prírodného benzaldehydu sa pripravuje z cinnamaldehydu, ktorý sa nachádza v škoricovom oleji. Pri takomto spôsobe prípravy sa cinnamaldehyd zahrieva 5 – 80 hodín na 90 °C až 150 °C v alkoholovom roztoku spolu so zásadou ako napríklad uhličitan sodný alebo hydrogenuhličitan sodný. Touto reakciou vzniká benzaldehyd, ale aj acetaldehyd[3] a preto sa benzaldehyd musí oddeliť destiláciou.
Výskyt
Benzaldehyd spolu s podobnými chemikáliami sa vyskytuje v mnohých jedlách. Najviac benzaldehydu, ktorý zjeme je prírodný a pochádza z rastlinných produktov, ako napríklad mandle.[4]
Mandle, jablká, jadierka z čerešní a marhule obsahujú amygdalín. Ten sa v telách pomocou enzýmov metabolizuje na benzaldehyd, kyanovodík a glukózu.
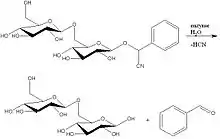
Reakcie
Benzaldehyd sa dá oxidovať na kyselinu benzoovú, ktorá sa často nachádza aj v laboratórnych vzorkách benzaldehydu. Kedže bod varu tejto kyseliny je o dosť vyšší než bod varu benzaldehydu, takže ho môžeme prečistiť oddestilovaním zo zmesi. Z benzaldehydu môžeme taktiež pripraviť benzylalkohol pomocou hydrogenácie. Reakciou benzaldehydu s octanom sodným a acetanhydridom vzniká kyselina škoricová. Benzoínovou kondenzáciou sa z neho za prítomnosti kyanidu draselného ako katalyzátoru v alkoholovom roztoku sa pripravuje benzoín.[5] Pri reakcii s koncentrovanými zásadami sa benzaldehyd rozkladá na benzylalkohol a kyselinu benzoovú.
Využitie
Benzaldehyd sa používa na dodanie mandľovej chuti rôznym jedlám. Niekedy sa takisto pridáva do kozmetických prípravkov.
Priemyselne sa používa na prípravu rôznych iných organických zlúčenín. Napríklad farbivo malachitová zeleň sa vyrába reakciou benzaldehydu s dimetylanilínom. Benzaldehyd sa používa taktiež na prípravu akridínových farbív. Pomocou aldolovej kondenzácie sa z benzaldehydu pripravujú deriváty cinnamaldehydu a styrénu. Reakciou s kyselinou kyanovodíkovou sa pripravuje kyselina mandľová, vznikajúci medziprodukt sa hydrolyzuje na výslednú kyselinu mandľovú.
Bezpečnosť
Americké agentúry FDA a FEMA[4] označili ako všeobecne považovaný za bezpečný. Európska únia povoľuje jeho použitie ako dochucovadlo.[6] Toxikologické výskumy naznačujú, že benzaldehyd je bezpečný a nie je karcinogénny v koncentráciách pridávaných do jedál a kozmetiky a dokonca môže mať aj karcinostatické (rakovinu potláčajúce) účinky.
Pre 70 kg človeka sa letálna dávka odhaduje na 50 ml čistého benzaldehydu. Odporúčaná denná dávka benzaldehydu je 15 mg/deň.[7] Benzaldehyd sa nebioakumuluje v ľudských tkanivách a po metabolizovaní sa vylučuje v moči.
Referencie
- https://books.google.sk/books?id=85yUennC-pUC&pg=PA87&redir_esc=y#v=onepage&q&f=false
- https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a03_463
- https://patents.google.com/patent/US4617419
- https://www.sciencedirect.com/science/article/pii/S0278691504003448?via%3Dihub
- http://www.chtf.stuba.sk/koch/LC%20Materials%20zima%2011-12/vzorovy_protokol.pdf
- https://journals.sagepub.com/doi/10.1080/10915810600716612
- https://cfpub.epa.gov/ncea/risk/recordisplay.cfm?deid=41551


