Trimethylsilylkyanid
Trimethylsilylkyanid je organická sloučenina se vzorcem (CH3)3SiCN, skládající se z kyanidové (CN-) a trimethylsilylové skupiny. Používá se v organické syntéze jako ekvivalent kyanovodíku. Připravuje se reakcí kyanidu lithného s trimethylsilylchloridem.[2]
| Trimethylsilylkyanid | |
|---|---|
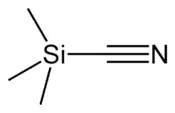
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | trimethylsilankarbonitril |
| Funkční vzorec | (CH3)3SiCN |
| Sumární vzorec | C4H9SiN |
| Identifikace | |
| Registrační číslo CAS | 7677-24-9 |
| EC-no (EINECS/ELINCS/NLP) | 231-657-3 |
| PubChem | 82115 |
| SMILES | C[Si](C)(C)C#N |
| InChI | 1S/C4H9NSi/c1-6(2,3)4-5/h1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 99,206 g/mol |
| Teplota tání | 8 až 11 °C (281 až 284 K) |
| Teplota varu | 114 až 117 °C (387 až 390 K) |
| Hustota | 0,793 g/cm3 (20 °C) |
| Index lomu | 1,392 |
| Rozpustnost ve vodě | reaguje |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H300 H310 H330 H400 H410[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P260 P262 P264 P270 P271 P273 P280 P284 P302+352 P303+361+353 P304+340 P321 P330 P370+378 P391 P403+233 P403+235 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
LiCN + (CH3)3SiCl → (CH3)3SiCN + LiCl
Struktura
Struktura této sloučeniny je podobná jako u jiných nitrilů. Vyskytuje se v rovnováze s malým množstvím izomerního izokyanidu (CH3)3SiNC.[3]
Téměř izostrukturní terc-butylnitril se na terc-butylizokyanid přeměňuje obtížně.
Reakce
Trimethylsilylkyanid může být hydrolyzován na kyanovodík a trimethylsilanol:
- (CH3)3SiCN + H2O → (CH3)3SiOH + HCN
Váže se na dvojné vazby uhlík-kyslík, například u aldehydů, za tvorby nových vazeb uhlík–uhlík:
- RCH=O + (CH3)3SiC≡N → N≡C–CHR–OSi(CH3)3
Produktem je O-silylovaný kyanhydrin.
Další využití nachází trimethylsilylkyanid při přeměnách pyridin-N-oxidů na 2-kyanopyridiny. Tyto reakce se nejlépe provádějí pomocí dimethylkarbamoylchloridu (jako aktivujícího elektrofilu) v dichlormethanu. Je možné i použití benzoylchloridu, kdy se ovšem objevuje nižší výtěžnost i regioselektivita.
Acetonkyanohydrin může z této látky vratně uvolňovat kyanidové anionty.[4] (4)

Bezpečnost
Trimethylsilylkyanid je „toxický při požití, styku s kůží či vdechnutí“, protože se působením vody hydrolyzuje na plynný kyanovodík.
Při likvidaci se doporučuje přidání zředěného roztoku hydroxidu alkalického kovu.[5]
Reference
V tomto článku byl použit překlad textu z článku Trimethylsilyl cyanide na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/82115
- LIVINGHOUSE, T. Trimethylsilyl Cyanide: Cyanosilation of p-Benzoquinone. Org. Synth.. 1990. Dostupné online. (anglicky); Coll. Vol.. S. 517. (anglicky)
- M. R. Booth; S. G. Frankiss. Trimethylsilyl isocyanide. Chemical Communications. 1968, s. 1347–1348. DOI 10.1039/C19680001347.
- Nazarov, N. ; Zav'yalov, I. J. Gen. Chem. USSR (Engl. Transl.) 1954, 24, 475 [C.A., 49, 6139f (1955)].
- MSDS of trimethylsilyl cyanide. (PDF). Gelest. [Jun 13, 2019]


