Chlorid dusitý
Chlorid dusitý, též známý jako trichloramin, trichlornitrid nebo chlorodusík, je anorganická sloučenina se vzorcem NCl3. Tato žlutá, olejovitá, štiplavě páchnoucí kapalina je nejrozšířenějším vedlejším produktem reakcí mezi deriváty amoniaku a chlorem (například v plaveckých bazénech při reakci moči plavců s chlorem, který se do vody přidává kvůli dezinfekci).
| Chlorid dusitý | |
|---|---|
 | |

Trichloramin | |
| Obecné | |
| Systematický název | chlorid dusitý |
| Triviální název | chlorodusík |
| Ostatní názvy | trichloramin |
| Latinský název | Nitrogenii chloridum Nitrogenium chloratum |
| Anglický název | Nitrogen trichloride |
| Německý název | Stickstofftrichlorid |
| Sumární vzorec | NCl3 |
| Vzhled | žlutá olejovitá kapalina |
| Identifikace | |
| Registrační číslo CAS | 10025-85-1 |
| PubChem | 61437 |
| ChEBI | 37382 |
| SMILES | ClN(Cl)Cl |
| InChI | 1S/Cl3N/c1-4(2)3 |
| Číslo RTECS | QW974000 |
| Vlastnosti | |
| Molární hmotnost | 120,365 g/mol |
| Teplota tání | −40 °C |
| Teplota varu | 71 °C |
| Hustota | 1,635 g/cm3 |
| Rozpustnost ve vodě | nerozpustný (pomalá hydrolýza) |
| Struktura | |
| Krystalová struktura | klencová |
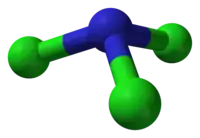
| Tvar molekuly | trojúhelníkový pyramidální |
| Dipólový moment | 0,6 D |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | +232 kJ/mol |
| Bezpečnost | |
| NFPA 704 |  0
2
4
OX
|
| Teplota vznícení | 93 °C |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
V čisté formě je NCl3 vysoce reaktivní. V malých množstvím může vznikat při dezinfekci pitné vody monochloraminem, vyšší hladiny mohou dráždit sliznice.[1] Chlorid dusitý vyráběný pod obchodní značkou Agene se používal k bělení a zrání mouky. Má stejný účinek jako slzný plyn, ale nikdy nebyl pro tento účel používán.[2]
Příprava a struktura
Sloučenina se připravuje působením chloru na amonné soli, například amoniak:
- 4 NH3 + 3 Cl2 → NCl3 + 3 NH4Cl
Meziprodukty v této konverzi jsou chloramin a dichloramin (NH2Cl, resp. NHCl2).
Podobně jako amoniak, i NCl3 má pyramidovou molekulu. Vzdálenosti N-Cl jsou 1,76 Å, úhly Cl-N-Cl 107°.[3] Paulingovy elektronegativity jsou velmi podobné dusíku (3,04) a chloru (3,16).
Reakce
Oxidační číslo dusíku v NCl3 se často uvažuje jako −3, atomy chloru pak mají oxidační číslo +1. Většina reaktivních vlastností je s tímto popisem konzistentní.
Chlorid dusitý je v horké vodě hydrolyzován na amoniak a kyselinu chlornou:
- NCl3 + 3 H2O → NH3 + 3 HClO
Bezpečnost
Chlorid dusitý je nebezpečná výbušnina. Je citlivý na světlo, teplo a přítomnost organických sloučenin. Pierre-Louis Dulong ho poprvé připravil v roce 1812; při dvou explozích přišel o dva prsty a oko. Následkem výbuchu NCl3 byl dočasně oslepen Sir Humphry Davy, který proto zaměstnal jako svého spolupracovníka Michaela Faradaye. Belgičtí vědci ohlásili možné spojení mezi NCl3 a vzestupem počtu případů astmatu u dětí, což nazvali hypotézou bazénového chloru jakožtou alternativu k hygienické hypotéze s těsnější příčinnou vazbou.[4]
Výskyt v bazénech
Trichloramin je zodpovědný za typický zápach bazénů, který lidé spíš nesprávně přisuzují chlóru. Může způsobit akutní podráždění spojivek a vyvolat slzení, kašel nebo obtížné dýchání.[5]
Reference
V tomto článku byl použit překlad textu z článku Nitrogen trichloride na anglické Wikipedii.
- National Institute for Occupational Safety and Health. (2008, August). NIOSH eNews, 6(4). Retrieved August 27, 2008, from http://www.cdc.gov/niosh/enews/enewsV6N4.html
- George Clifford White: The handbook of chlorination and alternative disinfectants. 4th Edition, Wiley, 1999, ISBN 978-0-471-29207-4, p. 322
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Bernard A, Carbonnelle S, de Burbure C, Michel O, Nickmilder M. Chlorinated pool attendance, atopy, and the risk of asthma during childhood. Environmental Health Perspectives. 2006, roč. 114, čís. 10, s. 1567–1573. Dostupné v archivu pořízeném dne 28-05-2008. DOI 10.1289/ehp.8461. PMID 17035144. Archivováno 28. 5. 2008 na Wayback Machine
- Astma u dětí: Může souviset s chlórem v bazénu?
Literatura
- Jander, J. (1976). Adv. Inorg. Chem. Radiochem. 19: 2.
- P. Kovacic, M. K. Lowery, K. W. Field. Chemistry of N-bromamines and N-chloramines. Chemical Reviews. 1970, roč. 70, čís. 6, s. 639. DOI 10.1021/cr60268a002.
- Hartl, H.;, Schoner, J.; Jander, J.; Schulz, H. Structure of Solide Nitrogen-Trichloride (-125 °C). Zeitschrift für Anorganische und Allgemeine Chemie. 1975, roč. 413, čís. 1, s. 61–71. DOI 10.1002/zaac.19754130108.
- Cazzoli, G.; Favero, P. G.; Dalborgo, A. Molecular-Structure, Nuclear-Quadruple Coupling-Constant and Dipole-Moment of Nitrogen Trichloride from Microwave Spectroscopy. Journal of Molecular Spectroscopy. 1974, roč. 50, čís. 1–3, s. 82. DOI 10.1016/0022-2852(74)90219-7.
- Bayersdo, L.; Engelhar, U., Fischer, J.; Hohne, K.; Jander, J. Nitrogen-chlorine compounds: Infrared spectra and Raman spectra of nitrogen trichloride. Zeitschrift für anorganische und allgemeine Chemie. 1969, roč. 366, čís. 3–4, s. 169-. DOI 10.1002/zaac.19693660308.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid dusitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid dusitý na Wikimedia Commons - (anglicky) OSHA – Nitrogen trichloride Archivováno 5. 9. 2008 na Wayback Machine