Sulfiniminy
Sulfiniminy (také nazývané N-sulfinyliminy nebo thiooxim-S-oxidy) jsou organické sloučeniny, druh iminů, které mají sulfinové skupiny navázané na atom dusíku.[1][2][3][4][5][6][7][8] Sulfiniminy díky přítomnosti chirální N-sulfinylové odtahující elektrony reagují stereoselektivně. Lze pomocí nich provádět 1,2-adice organokovových sloučenin na iminy. N-sulfinylová skupina vytváří výraznou a předvídatelnou stereoselektivitu, racemizaci vzniklých produktů zabraňuje stabilizace na dusíkovém atomu (díky tomu je možné použít sulfiniminové skupiny jako chránící skupiny pro aminy). Sulfinylové chirální pomocníky lze snadno odstranit kyselou hydrolýzou. Adice organokovových sloučenin na N-sulfinyliminy je používána k přípravě aminů a jejich derivátů, které se často používají při asymetrické syntéze mnoha biologicky aktivních sloučenin.[1][2][3][4][5][6][7][8]
Příprava
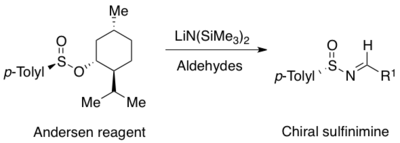
První metodu přípravy (racemických) sulfinimidů popsal Franklin A. Davis v roce 1974, šlo o oxidaci p-toluen-sulfenylimidů kyselinou m-chlorperoxybenzoovou.[9] O tři roky později byla popsána enantioselektivní příprava p-toluen-sulfinimidů reakcí Andersenova činidla (menthyl p-toluensulfinátu)[10] s metaloketiminy, takto však lze získat pouze N-sulfinyliminy s ketonovými skupinami.[11] Širší spektrum N-sulfinyliminů lze připravit asymetrickou oxidací nechirálních sulfenyliminů chirálními oxaziridiny.[12] Tento postup měl velký význam v začátcích rozvoje chemie N-sulfinyliminů, ovšem jeho využitelnost je omezena obtížností přípravy N-sulfonyloxaziridinu.[13] Vhodnější je příprava pomocí Andersenova činidla, kterou lze použít k získání p-toluen-sulfinyliminů z alifatických i aromatických aldehydů.[14]
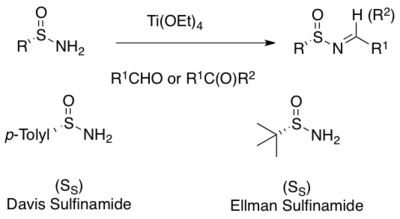
Nejčastějším způsobem asymetrické syntézy sulfiniminů je kondenzace enantiomerně čistých primárních sulfinamidů s aldehydy nebo ketony..[1][2][3][4][5][6][7] K usnadnění reakce se používají slabší Lewisovy kyseliny, jako například Ti(OCH2CH3)4 i jiná vysoušedla.[15][16] Mnoho sulfinamidů je možné zakoupit, a to jako (R)- i (S) izomery. Nejběžnější jsou p-toluen-sulfinamid (Davisův sulfinamid) a terc-butansulfinamid (Ellmanův sulfinamid).[8][15][16]
Použití
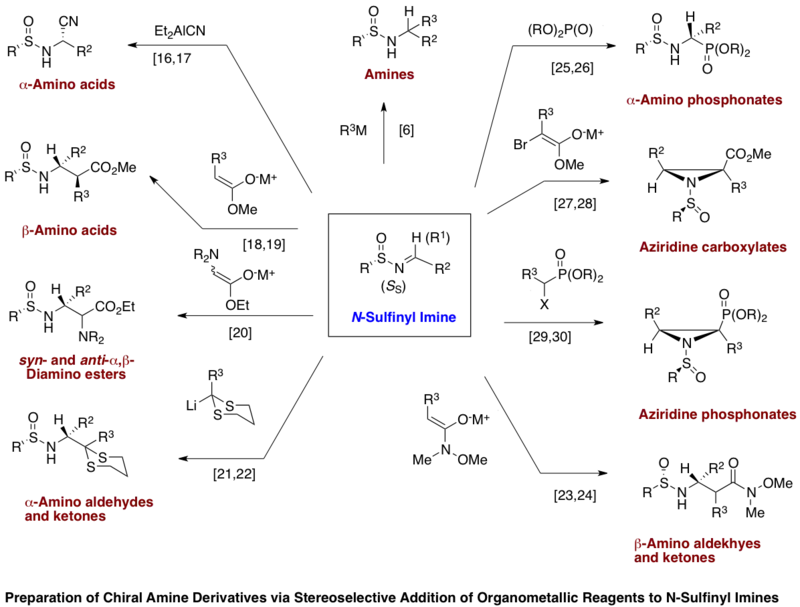
Deriváty p-toluensulfinyliminu lze použít při diastereoselektivní syntéze α-aminokyselin,[17][18] β-aminokyselin,[19][20] syn- a anti-2,3-diaminoesterů,[21] α-aminoderivátů aldehydů a ketonů,[22][23], β-aminoketonů,[24][25] α-aminofosfonátů,[26][27] aziridin-2-karboxylátů[28][29] a aziridin-2-fosfonátů.[30] Mnoho z těchto syntéz lze provést pomocí terc-butylsulfinyliminů;[8] při asymetrické syntéze aminů jsou nutné, protože organolithná a Grignardova činidla reagují se sulfinylovým atomem síry p-toluen-sulfinyliminů.[8] Přidáním slabších kyselin lze ze vzniklých sulfinamidů snadno odstranit N-sulfinylové skupiny, čímž se vytvoří samotné deriváty aminů. U terc-butylsulfinyliminů přitom dochází ke snadnému odstranění vedlejších produktů.[8]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku N-Sulfinyl imine na anglické Wikipedii.
- Franklin A. Davis; Ping Zhou; Bang-Chi Chen. Asymmetric synthesis of amino acids using sulfinimines (thiooxime S-oxides). Chemical Society Reviews. 1998, s. 13. DOI 10.1039/A827013Z.
- Franklin A. Davis; Ping Zhou; Bang-Chi Chen. Recent advances in asymmetric reactions using sulfinimines (N-sulfinyl imines). Tetrahedron. 2004, s. 8003. DOI 10.1016/j.tet.2004.06.07.
- Chris H. Senanayake; Dhileepkumar Krishnamurthy; Zhi-Hui Luy; I. Gallou. Enantiopure sulfoxides and sulfinamides: recent developments in their stereoselective synthesis and applications to asymmetric synthesis. Aldrichimica Acta. 2005, s. 93. DOI 10.1002/chin.200640264.
- Daniel Morton; Robert A. Stockman. Chiral non-racemic sulfinimines: versatile reagents for asymmetric synthesis. Tetrahedron. 2006, s. 8869. DOI 10.1016/j.tet.2006.06.107.
- Franklin A. Davis. Adventures in sulfur-nitrogen chemistry. Journal of Organic Chemistry. 2006, s. 8993. DOI 10.1021/jo061027p.
- Ramakrishna Edupuganti; Franklin A. Davis. Synthesis and Applications of Masked Oxo-Sulfinamides in Asymmetric Synthesis. Organic and Biomolecular Chemistry. 2012, s. 5021. DOI 10.1039/c2ob25345c.
- Franklin A. Davis; Arthur J. Friedman; Edward W. Kluger. Chemistry of the sulfur-Nitrogen Bond. VIII. N-Alkylidenesulfinamides. Journal of the American Chemical Society. 1974, s. 5000. DOI 10.1021/ja00822a055.
- Jonathan Ellman; Maryann T. Robak; Melissa A. Herbage. Synthesis and applications of tert-Butanesulfinamide. Chemical Reviews. 2010, s. 3600–3740. DOI 10.1021/cr900382t. PMID 20420386.
- Martin Hulce; John P. Mallomo; Leah L. Frye; Timothy P. Kogan; Gary H. Posner. Organic Syntheses Coll. Vol. 1990, s. 495.
- Mauro Cinquini; Franco Cozzi. Synthesis of Optically active N-alkylidenesulphinamides. Journal of the Chemical Society, Chemical Communications. 1977, s. 502. DOI 10.1039/c3977000502b.
- Franklin A. Davis; Thimma R. Reddy; Rajaraathnam E. Reddy. Asymmetric Synthesis of Sulfinimines: Applications to the Synthesis of Nonracemic β-Amino acids and α-hydroxy-β-amino acids. Journal of Organic Chemistry. 1992, s. 6387. DOI 10.1021/jo00050a007.
- Franklin A. Davis; Thimma R. Reddy; Wei Han; Patrick J. Carroll. Chemistry of Oxaziridines. 17. N-(Phenylsulfonyl)(3,3-dichlorocamphoryl)oxaziridine: A Highly Efficient Reagent for the Asymmetric Oxidation of Sulfide to Sulfoxides. Journal of the American Chemical Society. 1992, s. 1428. DOI 10.1021/ja00030a045.
- Asymmetric Synthesis and Properties of Sulfinimines (Thiooxime S-Oxides). Journal of Organic Chemistry. 1997, s. 2555–2563. DOI 10.1021/jo970077e. PMID 11671597.
- Guangcheng Liu; Derek. A. Cogan; Timothy D. Owens; Tony P. Tang; Jonathan A. Ellman. Synthesis of Enantiomerically Pure N-tert-Butanesulfinyl Imines (tert-Butanesulfinimines) by the Direct Condensation of tert-Butanesulfinamide with aldehydes and ketones. Journal of Organic Chemistry. 1999, s. 1278. DOI 10.1021/jo982059i.
- Franklin A. Davis; Zhang Yulian; Yemane Andemichael; Tianan Fang; Dean L. Fanelli. Improved Synthesis of Enantiopure Sulfinimines (Thiooxime S-Oxides) from p-Toluenesulfinamides and Aldehydes and Ketones. Journal of Organic Chemistry. 1999, s. 1403. DOI 10.1021/jo9820622.
- Franklin A. Davis; Padma S. Portonovo; Rajarathnam E. Reddy; Yu-hung Chiu. Asymmetric Strecker Synthesis using Enantiopure Sulfinimines and Diethylaluminum Cyanide: The Alcohol Effect. Journal of Organic Chemistry. 1996, s. 440. DOI 10.1021/jo9519928.
- Franklin A. Davis; Vaidyanathan Srirajan; Donald D. Titus. Efficient Asymmetric Synthesis of β-Fluoro α-Amino Acids. Journal of Organic Chemistry. 1999, s. 6931. DOI 10.1021/jo990947n.
- Franklin A. Davis; Rajarathnam E. Reddy; Joanna M. Szewczyk. Asymmetric Synthesis of (R)-(+)-β-Phenylalanine from (S)-(+)-Benzylidene-p-toluenesulfinamide. Regeneration of the Sulfinimine Precursor. Journal of Organic Chemistry. 1995, s. 7037. DOI 10.1021/jo00126a070.
- Franklin A. Davis; Joanna M. Szewczyk; Rajarathnam E. Reddy. An Efficient Synthesis of (+)-(S)-Ethyl-β-Amino-3-pyridinepropanoate Using Enantiopure Sulfinimines. Journal of Organic Chemistry. 1996, s. 2222. DOI 10.1021/jo951917x.
- Franklin A. Davis; Yanfeng Zhang; Hui Qiu. Asymmetric Synthesis of anti- and syn-2,3-Diamino Esters using Sulfinimines. Water and Concentration Effects. Organic Letters. 2007, s. 833. DOI 10.1021/ol063058c. PMID 17261004.
- Franklin A. Davis; Tokala Ramachandar; Liu Hu. Asymmetric Synthesis of α-Amino 1,3-Dithioketals from Sulfinimines (N-Sulfinyl Imines). Synthesis of (2S,3R)-(-)-3-Hydroxy-3-methylproline. Organic Letters. 2004, s. 3393. DOI 10.1021/ol0485971.
- Franklin A. Davis; Tokala Ramachandar; Jing Chai; Eduardas Skucas. Asymmetric Synthesis of α-Amino Aldehydes from Sulfinimine (N-Sulfinyl Imine)-Derived α-Amino 1,3-Dithianes. Formal Synthesis of (-)-2,3-trans-3,4-cis-Dihydroxy Proline. Tetrahedron Letters. 2006, s. 2743. DOI 10.1016/j.tetlet.2006.02.092.
- Asymmetric Synthesis of β-Amino Carbonyl Compounds with N-Sulfinyl β-Amino Weinreb Amides. Journal of Organic Chemistry. 2005, s. 2184. DOI 10.1021/jo0402780.
- Franklin A. Davis; Song Minsoo. Asymmetric Synthesis of syn-α-Substituted β-Amino Ketones using Sulfinimines and Prochiral Weinreb Amide Enolate. Organic Letters. 2007, s. 2413. DOI 10.1021/ol0708166.
- Franklin A. Davis; Seung Lee; Hongxing Yan; Donald D. Titus. Asymmetric Synthesis of Quaternary α-Amino Phosphonates using Sulfinimines. Organic Letters. 2007, s. 1757. DOI 10.1021/ol015945f.
- Franklin A. Davis; Seung Lee; He Xu. Asymmetric Synthesis of Cyclic α-Amino Phosphonates using Masked Oxo Sulfinimines (N-Sulfinyl Imines). Journal of Organic Chemistry. 2004, s. 3777. DOI 10.1021/jo040127x.
- Franklin A. Davis; Ping Zhou; G. Venkat Reddy. Asymmetric Synthesis and Reactions of cis-N-(p-Toluenesulfinyl)aziridine-2-carboxylic Acids. Journal of Organic Chemistry. 1994, s. 3243. DOI 10.1021/jo00091a001.
- Franklin A. Davis; Hu Liu; Ping Zhou; Tianan Fang; G. Venkat Reddy. Aza-Darzens Asymmetric Synthesis of N-p-(Toluenesulfinyl)aziridine 2-Carboxylate Esters from Sulfinimines (N-Sulfinyl Imines). Journal of Organic Chemistry. 1999, s. 7559. DOI 10.1021/jo990907j.
- Franklin A. Davis; William McCoull; Donald D. Titus. Asymmetric Synthesis of α-Methylphosphophenylalanine Derivatives using Sulfinimine Derived Chiral Enantiopure Aziridinyl-2-phosphonates. Organic Letters. 1999, s. 1053. DOI 10.1021/ol990855k.
- Franklin A. Davis; Yongzhong Wu; Hongxing Yan; William McCoull; Kavirayani R. Prasad. Asymmetric Synthesis of Aziridine 2-Phosphonates from Enantiopure Sulfinimines (N-Sulfinyl Imines). Synthesis of α-Amino Phosphonates. Journal of Organic Chemistry. 2003, s. 2410. DOI 10.1021/jo020707z.