Racemizace
Racemizace je chemický proces, při němž se enantiomerně čistá (je přítomen pouze jeden enantiomer) látka mění na směs několika enantiomerů. Při racemizaci dojde k vytvoření stejného množství D a L enantiomerů, vzniká tak racemická směs.[1][2]
Stereochemie
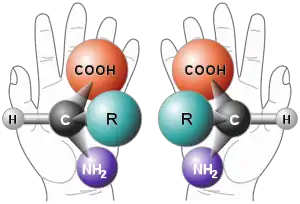
Chirální molekuly mají dvě formy (na každém chirálním centru), které se liší svými optickými vlastnostmi: (−) izomer stáčí rovinu polarizovaného světla doleva, zatímco (+) izomer ji stáčí doprava. Tyto dvě formy se nazývají enantiomery. Tato +/- notace by neměla být zaměňována s označováním D a L, které je odvozeno od struktury D- a L-glyceraldehydu.
Při racemizaci se jeden čistý enantiomer mění na stejná množství obou enantiomerů za vzniku racemické směsi. Je-li přítomno stejné množství (+) a (−) formy, pak k optické otáčivosti nedochází.[1] Enantiomery nejsou totéž jako diastereomery, druh stereoizomerů, které se liší strukturou molekuly kolem stereocentra a nejsou zrcadlovými obrazy.
Objev optické aktivity
Roku 1843 objevil Louis Pasteur optickou aktivitu u kyseliny parahroznové (racemické kyseliny vinné). Dokázal izolovat krystaly dvou enantiomerů, které otáčely rovinu polarozovaného světla opačným směrem.[2]
Vliv na fyzikální vlastnosti
Racemát má často odlišné fyzikální vlastnosti než každý jednotlivý enantiomer kvůli odlišným vnitromolekulárním interakcím. Přeměna z čistého enantiomeru na racemát může způsobit změnu hustoty, teploty tání, rozpustnosti, slučovacího tepla, indexu lomu a také různých spekter. Krystalizací racemické směsi mohou vzniknout oddělené (+) a (−) formy nebo jediná racemická látka.
Biologický význam
Většina biochemických reakcí je stereoselektivní, takže se jen jeden stereoizomer účastní reakce a druhý nereaguje nebo způsobuje vedlejší účinky; například u aminokyselin jsou obvykle biologicky aktivní L izomery a u sacharidů (hlavně glukózy) D-izomery, což je způsobeno tím, že mnoho biomolekul je chirálních a tak reakcemi se specifickými enantiomery vznikají čisté stereoizomery.[3] Důležitá je rovněž skutečnost, že všechny aminokyseliny se většinou vyskytují v L formě. Některé bakterie ovšem vytvářejí D aminokyselinové zbytky, z nichž se vytvářejí krátké polypeptidy, které lze nalézt v buněčných stěnách těchto bakterií. Zmíněné polypeptidy jsou hůře zpracovávány peptidázami a jsou syntetizovány bakteriálními enzymy namísto mRNA translace, při které se tvoří peptidy z L-aminokyselin.[3]
Stereoselektivní povaha většiny biochemických reakcí znamená, že různé enantiomery téže látky mají rozdílné chemické vlastnosti a účinky na organismy. Mnoho psychotropních látek má různou aktivitu či účinnost v závislosti na izomerech, například amfetamin se často dodává jako racemická směs, ovšem dextroamfetamin je aktivnější. Podobná situace je u metadonu, kde je jeden z izomerů opioidovým antagonistou, zatímco druhý je antagonistou NMDA.[4]
Racemizace léčiv může probíhat in vivo. R enantiomer thalidomidu je účinný proti ranním nevolnostem, zatímco jeho S enantiomer je teratogenní, způsobuje poškození zárodku v prvním trimestru těhotenství. Pokud je podán pouze jeden enantiomer, později lze v krevním séru najtít oba;[5] látka tak není považována za bezpečnou pro ženy v produktivním věku a i v ostatních případech je její používání pod přísným dohledem.[6][7]
U ibuprofenu má protizánětlivé účinky pouze jeden enantiomer, zatímco druhý je biologicky neúčinný. Obdobně je S stereoisomer citalopramu mnohem reaktivnější než R enantiomer.[2][3][8]
Konfigurační stabilita léčiv je z těchto důvodů předmětem zájmu ve farmaceutickém výzkumu.[9] Tvorba a analýza enantiomerů ve farmaceutickém průmyslu se studuje v oblasti chirální organické syntézy.
Tvorba racemických směsí
Racemizace lze dosáhnout pouhým smísením stejných množství dvou čistých enantiomerů.
K racemizaci může dojít během následujících procesů:
- Substituční reakce, při nichž vzniká karbokationtový meziprodukt, jako jsou jednomolekulární substituce, vedou k stereonespecifické adici substituentů, která vyústí v racemizaci.
- I když u jednomolekulárních eliminačních reakcí také vzniká karbokation, tak nedochází ke vzniku chirálních center. Místo toho se vytvoří několik geometrických izomerů v (E/Z) formách.
- Pokud při jednomolekulové alifatické elektrofilní substituci vzniká karbanion, který je rovinný nebo nemůže zůstat v pyramidální struktuře, pak někdy, ovšem ne vždy, proběhne racemizace.[10]
- Pokud při radikálové substituci vzniknou volné radikály na chirálním uhlíku, pak dojde téměř vždy k racemizaci.[11]
Zjišťování míry racemizace L-forem na směs L- a D-forem) je jednou z metod datování biologických vzorků ve tkáních s nízkou mírou obratu, forenzních vzorků a zkaměnělin. Tato metoda se nazývá aminokyselinové datování.
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Racemization na anglické Wikipedii.
- Streitwieser & Heathcock (1985) pp. 122–124
- NELSON, D. L.; COX, M. M. Lehninger Principles of Biochemistry. 6th. vyd. New York: W. H. Freeman, 2013. ISBN 1429234148. (anglicky)
- VOET, D.; VOET, J. G.; PRATT, C. W. Fundamentals of Biochemistry: Life at the Molecular Level. 4th. vyd. Hoboken, NJ: John Wiley & Sons, 2013. ISBN 0470547847. (anglicky)
- ARNOLD, L. E.; WENDER, P. H.; MCCLOSKEY, K.; SNYDER, S. H. Levoamphetamine and Dextroamphetamine: Comparative Efficacy in the Hyperkinetic Syndrome: Assessment by Target Symptoms.. Arch. Gen. Psychiatry. 1972, s. 816–822. DOI 10.1001/archpsyc.1972.01750300078015. PMID 4564954. (anglicky)
- Teo, S. K.; COLBURN, W. A.; TRACEWELL, W. G.; KOOK, K. A.; STIRLING, D. I.; JAWORSKY, M. S.; SCHEFFLER, M. A. Clinical pharmacokinetics of thalidomide. Clin. Pharmacokinet.. 2004, s. 311–327. DOI 10.2165/00003088-200443050-00004. PMID 15080764. (anglicky)
- STOLBERG, S. G. Thalidomide Approved to Treat Leprosy, With Other Uses Seen. The New York Times. 17 July 1998. Dostupné online [cit. 8 January 2012]. (anglicky)
- Use of thalidomide in leprosy [online]. World Health Organisation [cit. 2010-04-22]. Dostupné online. (anglicky)
- JACQUOT, C.; DAVID, D. J.; GARDIER, A. M.; SÁNCHEZ, C. Escitalopram and citalopram: the unexpected role of the R-enantiomer. Encéphale. 2007, s. 179–187. PMID 17675913. (anglicky)
- M. Reist, B. Testa, P.-A. Carrupt. Stereochemical Aspects of Drug Action and Disposition. Redakce Michel F. Eichelbaum, Bernard Testa, Andrew Somogyi. [s.l.]: [s.n.] (Handbook of Experimental Pharmacology; sv. 153). Dostupné online. DOI 10.1007/978-3-642-55842-9_4. Kapitola Drug Racemization and Its Significance in Pharmaceutical Research, s. 91–112. (anglicky)
- March (1985) pp. 517–518
- March (1985) p. 610