Redukce nitrilů
Redukce nitrilů jsou organické redoxní reakce, při kterých se nitrily redukují na aminy nebo aldehydy.[1]
Katalytická hydrogenace
Katalytická hydrogenace nitrilů je často nejjednodušším způsobem přípravy primárních aminů.[2]
Katalyzátory jsou mnohdy založeny na kovech 10. skupiny, jedná se například o Raneyův nikl,[3][4][5] palladiovou čerň nebo oxid platiničitý.[1] Dalším možným regioselektivním katalyzátorem tvorby primárních aminů je borid kobaltu.
- R-C≡N + 2 H2 → R-CH2NH2
Tento postup má průmyslové využití při výrobě hexamethylendiaminu, prekurzoru nylonu, z adiponitrilu.[6]
Za určitých reakčních podmínek mohou být iminové meziprodukty atakovány aminy za vzniku sekundárních a terciárních aminů:
2 R-C≡N + 4 H2 → (R-CH2)2NH + NH3 3 R-C≡N + 6 H2 → (R-CH2)3N + 2 NH3
Tyto reakce probíhají přes enaminy.[7]
Největší vliv na selektivitu syntéz primárních aminů má katalyzátor,[1] dalšími faktory jsou rozpouštědlo, pH reakční směsi, sterické efekty, tlak vodíku a teplota.
Stechiometrické redukce
K činidlům pro nekatalyzované redukce aminů patří například hydrid lithnohlinitý a borohydrid lithný,[8] diboran[9] a kovový sodík v alkoholových rozpouštědlech.[10]
Redukce na aldehydy
Nitrily lze redukovat také na aldehydy. Stephenova syntéza aldehydů využívá chlorid cínatý a kyselinu chlorovodíkovou k přípravě aldehydů hydrolýzou vznikající iminiové soli. Aldehydy je rovněž možné získat přenosovou hydrogenací a následnou hydrolýzou iminu. K činidlům použitelným při této reakci patří kyselina mravenčí ve spojení s katalyzátorem hydrogenace[11] a hydridy kovů, sloužící k adicím jednoho ekvivalentu vodíku na nitril, například borohydrid sodný redukuje nitrily v alkoholových rozpouštědlech za katalýzy chloridem kobaltnatým nebo Raneyovým niklem.[12]
Použít lze i diisobutylaluminiumhydrid, který slouží jako zdroj hydridových iontů, které navazuje na uhlíkové atomy nitrilů. Vzniklé iminy jsou poměrně stabilními meziprodukty, které se hydrolyzují na aldehydy.[13]
Mechanismus
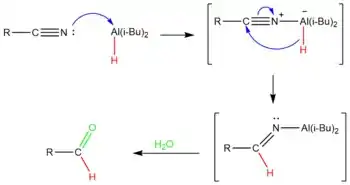
Diisobutylaluminiumhydrid se při částečných redukcích nitrilů používá za nízkých teplot.[14] Atom hliníku zde funguje jako Lewisova kyselina, která přijímá elektronový pár poskytnutý nitrilem. Nitril je následně redukován přesunem hydridového iontu na uhlík trojné vazby C-N, čímž se vytvoří imin. Po přidání vody se komplex hliníku hydrolyzuje na aldehyd.[15] Protože hydrolýza vytvářející aldehyd probíhá na konci procesu, tak nedochází k přeredukování.
Elektrochemické metody
Benzylnitrily mohou být také redukovány elektrochemicky.[16][17]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Nitrile reduction na anglické Wikipedii.
- Shigeo Nishimura. Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis. New York: Wiley-Interscience, 2001. ISBN 9780471396987. S. 406–411.
- Karsten Eller; Erhard Henkes; Roland Rossbacher; Hartmut Höke. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: [s.n.], 2000. ISBN 3527306730. DOI 10.1002/14356007.a02_001.
- B. S. Biggs; W. S. Bishop. Decamethylenediamine. Organic Syntheses. 1947, s. 18. DOI 10.15227/orgsyn.027.0018.
- C. F. H. Allen; C. V. Wilson. 2,4-Diphenylpyrrole. Organic Syntheses. 1947, s. 33. DOI 10.15227/orgsyn.027.0033.
- John C. Robinson; H. R. Snyder. β-Phenylethylamine. Organic Syntheses. 1943, s. 71. DOI 10.15227/orgsyn.023.0071.
- Michael Tuttle Musser. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: [s.n.], 2000. ISBN 3527306730. DOI 10.1002/14356007.a01_269. Kapitola Adipic Acid.
- J. Barrault. Synthesis of fatty amines. Selectivity control in presence of multifunctional catalysts. Catalysis Today. 1997, s. 137-153. DOI 10.1016/S0920-5861(97)00006-0.
- Atsuhiro Ookawa; Kenso Soai. Mixed solvents containing methanol as useful reaction media for unique chemoselective reductions within lithium borohydride. The Journal of Organic Chemistry. 1986, s. 4000-4005. DOI 10.1021/jo00371a017.
- R. O. Hutchins; B. E. Maryanoff. 2-tert-Butyl-1,3-diaminopropane. Organic Syntheses. 1973, s. 4000-4005. DOI 10.15227/orgsyn.053.0021.
- C. M. Suter; Eugene W. Moffett. The Reduction of Aliphatic Cyanides and Oximes with Sodium and n-Butyl Alcohol. Journal of the American Chemical Society. 1934, s. 487. DOI 10.1021/ja01317a502.
- T. van Es; B. Staskun. 4-Formylbenzenesulfonamide. Organic Syntheses. 1971, s. 20. DOI 10.15227/orgsyn.051.0020.
- Michael Smith. March's advanced organic chemistry : reactions, mechanisms, and structure. [s.l.]: Wiley, 2001. ISBN 9780471585893.
- Carey, F. A.; Sundberg, R. J.; Advanced Organic Chemistry, Part B: Reactions and Synthesis
- Francis A. Carey. Advanced organic chemistry. [s.l.]: Kluwer Academic/Plenum Pub, 2000. ISBN 0306462435.
- Solomons, T W. G, Craig B. Fryhle, and S A. Snyder. Organic Chemistry. , 2014. Print.
- V. Krishnan; A. Muthukumaran; H. V. K. Udupa. The electroreduction of benzyl cyanide on iron and cobalt cathodes. Journal of Applied Electrochemistry. 1979, s. 657–659. DOI 10.1007/BF00610957.
- V. Krishnan; A. Muthukumaran; H. V. K. Udupa. Process for Electrochemical Preparation of beta phenylethylamine using cobalt black cathode. [s.l.]: India Patent Office, 1983. Dostupné online.