Vazba uhlík-dusík
Vazba uhlík-dusík (C-N) je kovalentní vazba mezi atomy uhlíku a dusíku; jedná se o jednu z nejčastějších vazeb v organické chemii a biochemii.[1]
Dusík má pět valenčních elektronů a u jednoduchých aminů je trojvazný, přičemž dva elektrony nevyužité k tvorbě vazeb vytváří volný elektronový pár. Prostřednictvím tohoto páru může dusík vytvořit další vazbu s atomem vodíku, čímž se stane čtyřvazným a získá kladný náboj; vzniklá částice se nazývá amonný kation. Mnoho sloučenin dusíku má v důsledku této skutečnosti zásadité vlastnosti, zásaditost ovšem závisí na konfiguraci: dusíkové atomy v karboxamidech nejsou zásadité, protože je volný pár delokalizován na dvojné vazbě, u pyrrolů je příčinou to, že je volný pár součástí aromatického sextetu.
Podobně jako u vazeb uhlík-uhlík může být i mezi uhlíkem a dusíkem stabilní dvojná, jako u iminů, a trojná vazba, například u nitrilů. Délky vazeb C-N se pohybují od 147,9 pm u jednoduchých aminů po 147,5 pm u sloučenin typu C-N=, jako je nitromethan, 135,2 pm u částečně dvojných vazeb pyridinu a 115,8 pm u trojných vazeb v nitrilech.[2]
Vazba C-N bond je silně polarizovaná směrem k dusíku (elektronegativita uhlíku je 2,55 a u dusíku 3,04) a tak mohou mít molekuly, které ji obsahují, vysoké dipólové momenty: kyanamid 4,27 D, diazomethan 1,5 D, methylazid 2,17 D a pyridin 2,19 D. Tato polarita způsobuje, že mnoho sloučenin s vazbami C-N se rozpouští ve vodě.
Funkční skupiny obsahující dusík
| Skupina sloučenin | Řád vazby | Molekulový vzorec | Strukturní vzorex | Příklad | Průměrná délka vazby C–N (pm)[3] |
|---|---|---|---|---|---|
| Aminy | 1 | R2C-NH2 | 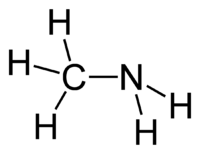 Methylamin |
146,9 (neutrální amin) 149,9 (amonná sůl) | |
| Aziridiny | 1 | CH2NHCH2 |  |
 Mitomycin |
147,2 |
| Azidy | 1 | R2C-N3 |  fenylazid |
||
| Aniliny | 1 | Ph-NH2 | 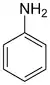 |
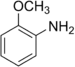 Anisidin |
135,5 (sp2 N) 139,5 (sp3 N) 146,55 (amonná sůl) |
| Pyrroly | 1 | 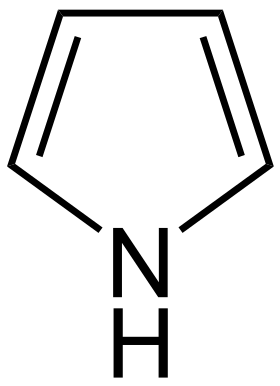 |
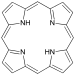 Porfyrin |
137,2 | |
| Amidy | 1,2 | R-CO-NR2 |  |
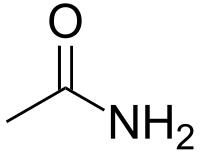 Acetamid |
132,5 (primární) 133,4 (sekundární) 134,66 (terciární) |
| Pyridiny | 1,5 | pyr | 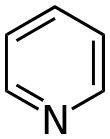 |
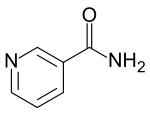 Nikotinamid |
133,7 |
| Iminy | 2 | R2C=NR | 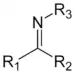 |
 DBN |
127,9 (C=N) 146,5 (C–N) |
| Nitrily | 3 | R-CN | 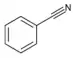 Benzonitril |
113,6 | |
| Isonitrily | 3 | R-NC | TOSMIC |
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Carbon–nitrogen bond na anglické Wikipedii.
- Organic Chemistry John McMurry 2nd Ed.
- CRC Handbook of Chemistry and Physics 65Th Ed.
- F. H. Allen, O. Kennard, D. G. Watson, L. Brammer, A. G. Orpen. Tables of bond Lengths determined by X-Ray and Neutron Diffraction. Part 1. Bond Lengths in Organic Compounds. J. Chem. Soc. Perkin Trans. II 1987, S1-S19.