Plutonocen
Plutonocen, Pu(C8H8)2, je organická sloučenina obsahující atom plutonia navázaný mezi dva cyklooktatetraenidové anionty (COT2-), čímž vytváří sendvičovou strukturu. Jedná se o tmavě červenou pevnou látku citlivou na vzduch a slabě rozpustnou v toluenu a chlorovaných uhlovodících.[1][2]
| Plutonocen | |
|---|---|
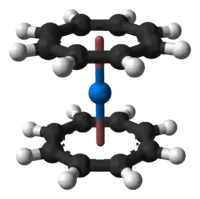
Model molekuly | |
| Obecné | |
| Systematický název | plutonocen |
| Sumární vzorec | C8H8Pu |
| Vzhled | červené krystaly (pevná látka) |
| Identifikace | |
| SMILES | [Pu].C1=CC=CC=CC=C1.C1=CC=CC=CC=C1 |
| InChI | 1S/2C8H8.Pu/c2*1-2-4-6-8-7-5-3-1;/h2*1-8H;/b2*2-1-,3-1-,4-2-,5-3-,6-4-,7-5-,8-6-,8-7-; |
| Vlastnosti | |
| Molární hmotnost | 452 g/mol |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v polárních rozpouštědlech |
slabě rozpustný v chlorovaných uhlovodících |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Plutonocen patří mezi aktinoceny, skupinu metalocenů obsahujících aktinoidy v oxidačním čísle +4.
Ve srovnání s ostatními aktinoceny, jako je uranocen, je plutonocen kvůli své silné radioaktivitě méně zkoumán.[3][4] Častěji se tato látka zkoumá v teoretických studiích zaměřených na vazby v jejích molekulách.[4][5]
Struktura
Struktura plutonocenu byla zjištěna pomocí monokrystalové rentgenové difrakce.[3][4]
Cyklooktatetraenidové kruhy jsou navzájem v zákrytu a zaujímají rovinnou konformaci, kde má všech 8 vazeb C–C stejnou délku 141 pm; v molekule se nachází inverzní centrum v poloze, kterou zaujímá atom plutonia.[3][4] Vzdálenosti atomů plutonia od středu jsou 190 pm a vazby Pu–C jsou dlouhé od 263 do 264 pm.[3]
I přes podobné struktury molekul krystaly plutonocenu nejsou izomorfní s ostatními aktinoceny, jelikož plutonocen krystalizuje v jednoklonné soustavě s prostorovou grupou I2/m, zatímco krystaly thorocenu, protaktinocenu, uranocenu a neptunocenu sou sice také jednoklonné, ale jejich prostorová grupa je P21/n.[3]
Teoretické výpočty naznačují u plutonocenu výskyt obohacených kovalentních vazeb, vznikajících interakcemi 6d a 5f orbitalů plutonia s π orbitaly ligandů.[2][4][5]
Příprava
Plutonocen byl poprvé připraven v roce 1970 reakcí hexachloroplutoničitanu tetraethylamonného ([N(C2H5)4]2PuCl6) s cyklooktatetraenidem draselným (K2(C8H8)) v tetrahydrofuranu za pokojové teploty:[1][2]
(NEt4)2PuCl6 + 2 K2(C8H8) → Pu(C8H8)2 + 2 NEt4Cl + 4 KCl
Tento postup se liší od příprav ostatních aktinocenů, kde se obvykle používá reakce chloridu, AnCl4, s K2(C8H8); u plutonia takovýto postup není možný, protože chlorid plutoničitý není stálý.[4] Reakci nelze provést ani s cesnými a pyridiniovými hexachloroplutoničitany namísto tetraethylamonných.[1]
Byl také vyvinut jiný postup, založený na jednoelektronové oxidaci zeleného komplexu [K(krypt)][PuIII(C8H8)2] jodidem stříbrným (AgI):[3]
- [PuIII(C8H8)2]− + AgI → Pu(C8H8)2 + Ag0 + I−
Anion [PuIII(C8H8)2]− se získává substitucí z K2(C8H8) a jiných organoplutonitých komplexů, které lze vytvořit redukcí oxidu plutoničitého bromovodíkem (HBr) v tetrahydrofuranu (THF).[3] Jako zdroje plutonia zde mohou sloužit i chlorid a jodid plutonitý.[3][4]
Ostatní vlastnosti
Plutonocen je chemicky podobný uranocenu a neptunocenu a reaguje téměř stejně. Tyto tři látky se nerozkládají působením vody a zředěných roztoků zásad, ale jsou citlivé na vzduch a rychle se mění na oxidy.[1][2][3] Vykazují pouze nízkou (s nasycenými koncentracemi okolo 10−3 mol/dm3) rozpustnost v aromatických a chlorovaných rozpouštědlech, jako jsou benzen, toluen, tetrachlormethan a chloroform.[1][2]
Reference
V tomto článku byl použit překlad textu z článku Plutonocene na anglické Wikipedii.
- David G. Karraker; John Austin Stone; Erwin Rudolph Jones; Norman Edelstein. Bis(cyclooctatetraenyl)neptunium(IV) and bis(cyclooctatetraenyl)plutonium(IV). Journal of the American Chemical Society. 1970, s. 4841–4845. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00719a014.
- Norman N. Greenwood; Alan Earnshaw. Chemistry of the Elements. Boston: Butterworth-Heinemann, 1997. Dostupné online. ISBN 978-0-08-037941-8. S. 1278–1280.
- Cory J. Windorff, Joseph M. Sperling, Thomas E. Albrecht-Schönzart, Zhuanling Bai, William J. Evans, Alyssa N. Gaiser, Andrew J. Gaunt, Conrad A. P. Goodwin, David E. Hobart, Zachary K. Huffman, Daniel N. Huh. A Single Small-Scale Plutonium Redox Reaction System Yields Three Crystallographically-Characterizable Organoplutonium Complexes. Inorganic Chemistry. 2020-09-21, s. 13301–13314. Dostupné online. ISSN 0020-1669. DOI 10.1021/acs.inorgchem.0c01671. PMID 32910649.
- Christos Apostolidis; Olaf Walter; Jochen Vogt; Phil Liebing; Laurent Maron; Frank T. Edelmann. A Structurally Characterized Organometallic Plutonium(IV) Complex. Angewandte Chemie International Edition. 2017, s. 5066–5070. ISSN 1521-3773. DOI 10.1002/anie.201701858. PMID 28371148.
- Andrew Kerridge. Oxidation state and covalency in f-element metallocenes (M = Ce, Th, Pu): a combined CASSCF and topological study. Dalton Transactions. 2013-11-06, s. 16428–16436. Dostupné online. ISSN 1477-9234. DOI 10.1039/C3DT52279B. PMID 24072035.