Pinakolboran
Pinakolboran je organoboran se vzorcem (CH3)4C2O2BH. Obsahuje borohydridovou funkční skupinu, která je součástí pětičlenného C2O2B kruhu. Jako i podobné alkoxidy boru je pinakolboran monomerní.[2]
| Pinakolboran | |
|---|---|
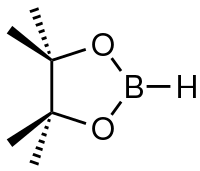
Strukturní vzorec | |
| Obecné | |
| Systematický název | 4,4,5,5-tetramethyl-1,3,2-dioxaborolan |
| Ostatní názvy | HBpin |
| Sumární vzorec | C6H13BO2 |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 106-93-4 |
| EC-no (EINECS/ELINCS/NLP) | 203-444-5 |
| PubChem | 6364989 |
| ChEBI | 28534 |
| SMILES | C(CBr)Br |
| InChI | 1S/C2H4Br2/c3-1-2-4/h1-2H2 |
| Vlastnosti | |
| Molární hmotnost | 127,98 g/mol |
| Teplota varu | 42 až 43 °C (315 až 316 K) (6,7 kPa) |
| Hustota | 0,882 g/cm3 |
| Bezpečnost | |
| [1] | |
| H-věty | H220 H225 H260 H261 H315 H318}[1] |
| P-věty | P210 P223 P231+232 P240 P241 P242 P243 P264 P280 P302+352 P303+361+353 P305+351+338 P310 P321 P332+313 P335+334 P362 P370+378 P377 P381 P402+404 P403 P403+235 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
V jeho molekule se nachází reaktivní vazby B-H.[3]
Použití v organické syntéze
Za přítomnosti vhodného katalyzátoru pinakolboran hydroboruje alkeny a v menší míře také alkyny.[3][4]
Pinakolboran také usnadňuje bezkatalyzátorové hydroborace aldehydů,[5] ketonů[6] a karboxylových kyselin.[7]
Pinakolboran se používá při borylačních reakcích, což je druh aktivace vazby uhlík-vodík.[8][9]
Dehydrogenací pinakolboranu vzniká bis(pinakoláto)dibor (B2pin2):[10]
- 2 (CH3)4C2O2BH → (CH3)4C2O2B-BO2C2(CH3)4 + H2
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Pinacolborane na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/6364989
- P. Veeraraghavan Ramachandran; J. Subash Chandra; Abel Ros; Rosario Fernández; José M. Lassaletta; Varinder K. Aggarwal; Daniel J. Blair. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2017. ISBN 9780470842898. Kapitola Pinacolborane, s. 1–12.
- H. C. Brown; M. Zaidlewicz. Organic Syntheses Via Boranes, Vol. 2. Milwaukee: Aldrich Chemical, 2001. ISBN 978-0-9708441-0-1.
- Robert J. Ely; James P. Morken. Stereoselective Nickel-Catalyzed 1,4-Hydroboration of 1,3-Dienes. Organic Syntheses. 2011, s. 342. DOI 10.15227/orgsyn.088.0342.
- Hanna Stachowiak; Joanna Kaźmierczak; Krzysztof Kuciński; Grzegorz Hreczycho. Catalyst-free and solvent-free hydroboration of aldehydes. Green Chemistry. 2018, s. 1738–1742. ISSN 1463-9262. DOI 10.1039/C8GC00042E.
- Weifan Wang; Man Luo; Weiwei Yao; Mengtao Ma; Sumod A. Pullarkat; Li Xu; Pak-Hing Leung. Catalyst-free and solvent-free hydroboration of ketones. New Journal of Chemistry. 2019, s. 10 744 – 10 749. ISSN 1144-0546. DOI 10.1039/C9NJ02722J.
- Adimulam Harinath; Jayeeta Bhattacharjee; Tarun K. Panda. Facile Reduction of carboxylic acids to primary alcohols under catalyst-free and solvent-free conditions. Chemical Communications. 2019, s. 1386–1389. ISSN 1359-7345. DOI 10.1039/C8CC08841A. PMID 30607398.
- K. Amaike; R. P. Loach; M. Movassaghi. Direct C7 Functionalization of Tryptophan. Synthesis of Methyl (S)-2-((tert-Butoxycarbonyl)amino)-3-(7-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1H-indol-3-yl)propanoate. Organic Syntheses. 2015, s. 373–385. DOI 10.15227/orgsyn.092.0373. PMID 26839440.
- Tatsuo Ishiyama; Jun Takagi; Yusuke Nobuta; Norio Miyaura. Iridium-Catalyzed C-H Borylation of Arenes and Heteroarenes: 1-Chloro-3-Iodo-5-(4,4,5,5-Tetramethyl-1,3,2-Dioxaborolan-2-Yl)Benzene and 2-(4,4,5,5,-Tetramethyl-1,3,2-Dioxaborolan-2-Yl)Indole. Organic Syntheses. 2005, s. 126. DOI 10.15227/orgsyn.082.0126.
- Emily C. Neeve; Stephen J. Geier; Ibraheem A. I. Mkhalid; Stephen A. Westcott; Todd B. Marder. Diboron(4) Compounds: From Structural Curiosity to Synthetic Workhorse. Chemical Reviews. 2016, s. 9091–9161. DOI 10.1021/acs.chemrev.6b00193. PMID 27434758.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.


