Organokovová chemie prvků 2. skupiny
Organokovová chemie prvků 2. skupiny označuje odvětví organokovové chemie zabývající se sloučeninami obsahujícími chemické vazby mezi atomy uhlíku a některého z prvků 2. skupiny periodické tabulky.[1][2] Nejběžnějšími takovými sloučeninami jsou Grignardova činidla, obsahující vazby uhlík–hořčík, široce používaná v organické chemii. Organokovové sloučeniny ostatních prvků této skupiny jsou vzácné a většinou je jejich využití omezeno na chemický výzkum.
Vlastnosti
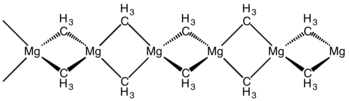
Protože prvky této skupiny obsahují dva valenční elektrony, tak mají jejich organokovové sloučeniny podobné vlastnosti jako příslušné sloučeniny prvků 12. skupiny. Snadno zaujímají oxidační číslo +2, vzácně mají jiná oxidační čísla a vykazují nižší elektronegativity než uhlík. Protože jsou však elektronegativity prvků 2. skupiny (s výjimkou beryllia) výrazně nižší, tak jsou vazby s uhlíkem více polarizované a podobají se iontovým vazbám, v případě sloučenin barya jsou plně iontové. Sloučeniny beryllia a hořčíku bývají obvykle považovány za kovalentní, ovšem mají některé vlastnosti odpovídající iontovým, protože má navázaný uhlík záporný dipólový moment. Tyto vlastnosti způsobují vysoká koordinační čísla a mnoho sloučenin (hlavně dialkyly) tvoří v pevném a kapalném skupenství polymery a v roztocích vysoce komplexní struktury, i když v plynném skupenství jsou většinou monomerní.
Metaloceny prvků 2. skupiny jsou vzácné, ovšem několik jich bylo připraveno. Bis(cyklopentadienyl)beryllium neboli beryllocen (Cp2Be), s dipólovým momentem 2,2 D, tvoří 5η/1η sendvičové molekuly. Přestože je magnesocen (Cp2Mg) pravým metalocenem, tak bis(pentamethylcyklopentadienyl)vápník (Cp*)2Ca má vazebný úhel 147°.
Příprava
Alkyl- a arylhalogenidy s jednou vazbou C-M a jednou vazbou C-X se obvykle připravují oxidačními adicemi. Sloučeniny tohoto druhu obsahující hořčík jsou známy jako Grignardova činidla; některé jejich vápenaté analogy jsou reaktivnější a více citlivé na rozklad. Vápenatá Grignardova činidla musí být předem aktivována.[5]
Níže jsou uvedeny základní postupy přípravy dialkylových a diarylových sloučenin prvků 2. skupiny:
- MX2 + R-Y → MR2 + Y-X'
- M'R2 + M → MR2 + M'
- Přes Schlenkovu rovnováhu:
- 2 RMX → MR2 + MX2
Příklady sloučenin
Organokovové sloučeniny hořčíku jsou široce rozšířené jako Grignardova činidla, ovšem příslušné sloučeniny ostatních prvků této skupiny jsou téměř výhradně předmětem akademického zájmu. Výzkum organoberyllnatých sloučenin je omezen vysokými náklady a toxicitou beryllia. Vápník je netoxický a levnější, ovšem organovápenaté sloučeniny se obtížně připravují a příprava odpovídajících sloučenin stroncia a barya je ještě náročnější. Tyto sloučeniny se využívají například při chemické depozici z plynné fáze.
Organoberyllium
Organoberyllnaté sloučeniny se často připravují alkylací chloridu berylnatého.[6] Ke známým organoberyllnatým sloučeninám patří například dineopentylberyllium,[7] beryllocen (Cp2Be),[8][9][10][11] diallylberyllium (získávané reakcí diethylberyllia s triallylboranem),[12] bis(1,3-trimethylsilylallyl)beryllium[13] a Be(mes)2.[6][14] Ligandy zde mohou být i arylové[15] a alkynylové skupiny.[16]
Organohořečnaté sloučeniny
Grignardova činidla se liší od organokovových sloučenin ostatních prvků 2. skupiny tím, že vznikají z organohalogenidů a kovu. Většina organických sloučenin těchto prvků se připravuje podvojnou záměnou, což omezuje jejich dostupnost. Grignardova činidla se připravují pomocí jednoelektronových přenosů. U méně reaktivních organohalogenidů se používají aktivované formy hořčíku připravované ve formě Riekeova hořčíku. Jako příklady Grignardových činidle lze uvést například fenylmagnesiumbromid a ethylmagnesiumbromid. Jejich zjednodušené vzorce mohou být zavádějící, protože se tyto sloučeniny obvykle vyskytují jako dietheráty, RMgX(ether)2, a narušují tak oktetové pravidlo.
Grignardova činidla se zapojují do Schlenkovy rovnováhy; pomocí níž se dá získat dimethylhořčík.
Mimo Grignardova činidla jsou známy i jiné organohořečnaté sloučeniny, například magnesiumanthracen, což je oranžová pevná látka používaná jako zdroj vysoce aktivního hořčíku. Butadienmagnesium s používá jako zdroj butadienových dianiontů. Rovněž jsou popsány átové komplexy hořčíku, jako je LiMgBu3.[17]
Organovápník
Dimethylvápník je možné připravit podvojnou záměnou z bis(trimethylsilyl)amidu vápenatého a methyllithia v diethyletheru:[18]
Dalším případem je (Cp)vápník(I).[zdroj?] V roce 2009 byla popsána příprava bis(allyl)vápníku[19] reakcí allyldraslíku s jodidem vápenatým; produkt vytváří stabilní bílý prášek:
Tato sloučenina obsahuje vazby typu η3 a může tvořit polymer s hapticitou η1 (CaCH2CHCH2)n.[20]
Ve stejném roce byla oznámena rovněž příprava [(thf)3Ca{μ-C6H3-1,3,5-Ph3}Ca(thf)3],[21][22] obrácené sendvičové sloučeniny s atomem vápníku na každé straně arenu.
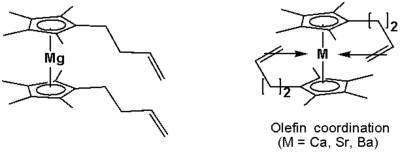
Alkeny navázané na cyklopentadienylové ligandy se mohou spojovat s vápenatými, strontnatými a barnatými ionty:[23]
Organovápenaté sloučeniny byly zkoumány jako možné katalyzátory.[24]
Organostroncium
Organostrontnaté sloučeniny byly identifikovány jako meziprodukty reakcí Barbierova typu.[25][26][27]
Organobaryum
Organické sloučeniny barya[28] druhu (allyl)BaCl lze připravit reakcemi aktivovaného (pomocí Riekeho metod redukce jodidu barnatého bifenylidem lithným) barya s allylhalogenidy.[29][30] Allylbarnaté sloučeniny reagují s organokarbonyly. Vykazují vyšší alfa-selektivitu a stereoselektivitu než Grignardova či organovápenatá činidla. Také byl popsán metalocen (Cp*)2Ba.[31]
Organoradium
Jedinou známou organoradnatou sloučeninou je acetylid, identifikovaný v plynném skupenství.
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Group 2 organometallic chemistry na anglické Wikipedii.
- Comprehensive Organometallic Chemistry by Mike Mingos, Robert Crabtree 2007 ISBN 978-0-08-044590-8
- C. Elschenbroich, A. Salzer Organometallics : A Concise Introduction (2nd Ed) (1992) from Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- WEISS, E. Die Kristallstruktur des Dimethylmagnesiums. Journal of Organometallic Chemistry. 1964, s. 314–321. DOI 10.1016/S0022-328X(00)82217-2. (anglicky)
- SNOW, A.I.; RUNDLE, R.E. Structure of Dimethylberyllium. Acta Crystallographica. 1951, s. 348-52. DOI 10.1107/S0365110X51001100. (anglicky)
- Reuben D. Rieke, Tse-Chong Wu, Loretta I. Rieke. Highly Reactive Calcium for the Preparation of Organocalcium Reagents: 1-Adamantyl Calcium Halides and Their Addition to Ketones: 1-(1-Adamantyl)cyclohexanol. Org. Synth.. 1995, s. 147. DOI 10.15227/orgsyn.072.0147. (anglicky)
- Off the Beaten Track—A Hitchhiker's Guide to Beryllium Chemistry D. Naglav, M. R. Buchner, G. Bendt, F. Kraus, S. Schulz, Angew. Chem. Int. Ed. 2016, 55, 10562. DOI:10.1002/anie.201601809
- COATES, G. E.; FRANCIS, B. R. Preparation of base-free beryllium alkyls from trialkylboranes. Dineopentylberyllium, bis(trimethylsilylmethyl)beryllium, and an ethylberyllium hydride. Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1971, s. 1308. DOI 10.1039/J19710001308. (anglicky)
- FISCHER, Ernst Otto; HOFMANN, Hermann P. Über Aromatenkomplexe von Metallen, XXV. Di-cyclopentadienyl-beryllium. Chemische Berichte. 1959, s. 482. DOI 10.1002/cber.19590920233. (anglicky)
- NUGENT, KW; BEATTIE, JK; HAMBLEY, TW; SNOW, MR. A precise low-temperature crystal structure of Bis(cyclopentadienyl)beryllium. Australian Journal of Chemistry. 1984, s. 1601. DOI 10.1071/CH9841601. (anglicky)
- ALMENNINGEN, A; HAALAND, Arne; LUSZTYK, Janusz. The molecular structure of beryllocene, (C5H5)2Be. A reinvestigation by gas phase electron diffraction. Journal of Organometallic Chemistry. 1979, s. 271. DOI 10.1016/S0022-328X(00)92065-5. (anglicky)
- WONG, C. H.; LEE, T. Y.; CHAO, K. J.; LEE, S. Crystal structure of bis(cyclopentadienyl)beryllium at −120 °C. Acta Crystallographica Section B. 1972, s. 1662. DOI 10.1107/S0567740872004820. (anglicky)
- WIEGAND, G.; THIELE, K.-H. Ein Beitrag zur Existenz von Allylberyllium- und Allylaluminiumverbindungen. Zeitschrift für anorganische und allgemeine Chemie. 1974, s. 101. DOI 10.1002/zaac.19744050111. (anglicky)
- CHMELY, Stephen C.; HANUSA, Timothy P.; BRENNESSEL, William W. Bis(1,3-trimethylsilylallyl)beryllium. Angewandte Chemie International Edition. 2010, s. 5870–4. DOI 10.1002/anie.201001866. PMID 20575128. (anglicky)
- Synthesis and structural characterization of the beryllium compounds [Be(2,4,6-Me3C6H2)2(OEt2)], [Be{O(2,4,6-tert-Bu3C6H2)}2(OEt2)], and [Be{S(2,4,6-tert-Bu3C6H2)}2(THF)].cntdot.PhMe and determination of the structure of [BeCl2(OEt2)2] Karin Ruhlandt-Senge, Ruth A. Bartlett, Marilyn M. Olmstead, and Philip P. Power Inorganic Chemistry 1993 32 (9), 1724-1728 DOI:10.1021/ic00061a031
- RUHLANDT-SENGE, Karin; BARTLETT, Ruth A.; OLMSTEAD, Marilyn M.; POWER, Philip P. Synthesis and structural characterization of the beryllium compounds [Be(2,4,6-Me3C6H2)2(OEt2)], [Be{O(2,4,6-tert-Bu3C6H2)}2(OEt2)], and [Be{S(2,4,6-tert-Bu3C6H2)}2(THF)].cntdot.PhMe and determination of the structure of [BeCl2(OEt2)2]. Inorganic Chemistry. 1993, s. 1724. DOI 10.1021/ic00061a031. (anglicky)
- MOROSIN, B; HOWATSON, J. The crystal structure of dimeric methyl-1-propynyl- beryllium-كس امك trimethylamine. Journal of Organometallic Chemistry. 1971, s. 7. DOI 10.1016/S0022-328X(00)87485-9. (anglicky)
- ARREDONDO, Juan D.; LI, Hongmei; BALSELLS, Jaume. Preparation of t-Butyl-3-Bromo-5-Formylbenzoate Through Selective Metal-Halogen Exchange Reactions. Organic Syntheses. 2012, s. 460. DOI 10.15227/orgsyn.089.0460. (anglicky)
- "Dimethylcalcium" Benjamin M. Wolf, Christoph Stuhl, Cäcilia Maichle-Mössmer, and Reiner Anwander J. Am. Chem. Soc. 2018, Volume 140, Issue 6, Pages 2373–2383 DOI:10.1021/jacs.7b12984
- "Bis(allyl)calcium" Phillip Jochmann, Thomas S. Dols, Thomas P. Spaniol, Lionel Perrin, Laurent Maron, Jun Okuda Angewandte Chemie International Edition Volume 48 Issue 31, Pages 5715–5719 2009 DOI:10.1002/anie.200901743
- Lichtenberg, C., Jochmann, P., Spaniol, T. P. and Okuda, J. (2011), "The Allylcalcium Monocation: A Bridging Allyl Ligand with a Non-Bent Coordination Geometry". Angewandte Chemie International Edition, 50: 5753–5756. DOI:10.1002/anie.201100073
- "Stable 'Inverse' Sandwich Complex with Unprecedented Organocalcium(I): Crystal Structures of [(thf)2Mg(Br)-C6H2-2,4,6-Ph3] and [(thf)3Ca{μ-C6H3-1,3,5-Ph3}Ca(thf)3]" Sven Krieck, Helmar Görls, Lian Yu, Markus Reiher and Matthias Westerhausen Journal of the American Chemical Society, 2009, 131 (8), pp 2977–2985 DOI:10.1021/ja808524y
- "Organometallic Compounds of the Heavier s-Block Elements—What Next?" J. David Smith Angewandte Chemie International Edition 2009, 48, 6597–6599 DOI:10.1002/anie.200901506
- H. Schumann; S. SCHUTTE; H.-J. KROTH; D. LENTZ. Butenyl-Substituted Alkaline-Earth Metallocenes: A First Step towards Olefin Complexes of the Alkaline-Earth Metals. Angewandte Chemie International Edition. 2004, s. 6208–6211. DOI 10.1002/anie.200460927. PMID 15549740. (anglicky)
- ARROWSMITH, Merle; CRIMMIN, Mark R.; BARRETT, Anthony G. M.; HILL, Michael S.; KOCIOK-KÖHN, Gabriele; PROCOPIOU, Panayiotis A. Cation Charge Density and Precatalyst Selection in Group 2-Catalyzed Aminoalkene Hydroamination. Organometallics. 2011, s. 1493–1506. DOI 10.1021/om101063m. (anglicky)
- MIYOSHI, N.; KAMIURA, K.; OKA, H.; KITA, A.; KUWATA, R.; IKEHARA, D.; WADA, M. The Barbier-Type Alkylation of Aldehydes with Alkyl Halides in the Presence of Metallic Strontium. Bulletin of the Chemical Society of Japan. 2004, s. 341. DOI 10.1246/bcsj.77.341. (anglicky)
- MIYOSHI, N.; IKEHARA, D.; KOHNO, T.; MATSUI, A.; WADA, M. The Chemistry of Alkylstrontium Halide Analogues: Barbier-type Alkylation of Imines with Alkyl Halides. Chemistry Letters. 2005, s. 760. DOI 10.1246/cl.2005.760. (anglicky)
- MIYOSHI, N.; MATSUO, T.; WADA, M. The Chemistry of Alkylstrontium Halide Analogues, Part 2: Barbier-Type Dialkylation of Esters with Alkyl Halides. European Journal of Organic Chemistry. 2005, s. 4253. DOI 10.1002/ejoc.200500484. (anglicky)
- Comprehensive organic functional group transformations Alan R. Katritzky, Otto Meth-Cohn, Charles Wayne Rees
- YANAGISAWA, A.; HABAUE, S.; YAMAMOTO, H. Allylbarium in organic synthesis: unprecedented .alpha.-selective and stereospecific allylation of carbonyl compounds. Journal of the American Chemical Society. 1991, s. 8955. DOI 10.1021/ja00023a058. (anglicky)
- YANAGISAWA, A.; HABAUE, S.; YASUE, K.; YAMAMOTO, H. Allylbarium Reagents: Unprecedented Regio- and Stereoselective Allylation Reactions of Carbonyl Compounds. Journal of the American Chemical Society. 1994, s. 6130. DOI 10.1021/ja00093a010. (anglicky)
- WILLIAMS, R. A.; HANUSA, T. P.; HUFFMAN, J. C. Solid state structure of bis(pentamethylcyclopentadienyl)barium, (Me5C5)2Ba; the first X-ray crystal structure of an organobarium complex. Journal of the Chemical Society, Chemical Communications. 1988, s. 1045. DOI 10.1039/C39880001045. (anglicky)