Nekekulovská molekula
Jako nekekulovské molekuly se označují konjugované uhlovodíky, které nelze popsat klasickou kekulovskou strukturou. Mají dvě nebo i více formálně nabitých radikálových center, jejichž spinové interakce mohou způsobovat elektrickou vodivost či feromagnetismus (molekulární magnety), což by mohlo najít využití; vzhledem k jejich vysoké reaktivitě a snadnému rozkladu či polymerizaci za pokojové teploty by bylo třeba vyvinout postupy pro jejich stabilizaci.
Tyto molekuly jsou obvykle připravovány a pozorovány s využitím matricové izolace.
Biradikály
Nejjednodušší nekekulovské molekuly jsou biradikálové. Biradikál je částice se sudým počtem elektronů se dvěma radikálovými centry, která jsou navzájem nezávislá. Jedná se o druh diradikálů.[1]
Jeden z prvních biradikálů připravil Wilhelm Schlenk v roce 1915 podobným způsobem jakým Moses Gomberg získal trifenylmethylový radikál. Do skupiny nazývané Schlenkovy-Braunsovy uhlvodíky patří:[2]
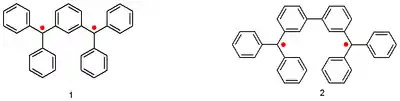
Eugene Müller pomocí Gouyovy váhy zjistil, že jsou tyto sloučeniny paramagnetické a mají tripletové základní stavy.
Další biradikál vytvořil Alexej Čičibabin v roce 1907.[3][4] Další byly připraveny například v letech 1960[5] a 1962.[6][7][8]
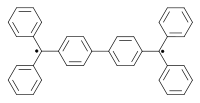 |
 |  | ||
| Čičibabinův biradikál (1907) | Yangův biradikál (1960) | Coppingerův biradikál 1962 | ||
Trimethylenmethan
Podrobně prozkoumaným biradikálem je trimethylenemethan (TMM), C4H6. V roce 1966 Paul Dowd zjistil pomocí elektronové paramagnetické rezonance, že jde o tripletovou molekulu. V krystalové formě je všech šest jeho vodíků rovnocenných.
Chinodimethany a polyaromatické uhlovodíky
K nekekulovským molekulám patří také biradikáloidové chinodimethany, šestičlenné kruhy s methylenovými substituenty.
Nekekulovské polyaromatické uhlovodíky obsahují několik spojených aromatických kruhů. Nejjednodušší takovou sloučeninou je triangulen. Po neúspěšných pokusech Ericha Clara v roce 1953, připravil roku 1995 Richard J. Bushby trioxytriangulen a Kazuhiro Nakasudži vytvořil roku 2001 stabilizovaný triangulen. V 2017 se poté podařilo připravit a zobrazit samotný triangulen.[9]
V roce 2019 byly získány větší homology triangulenu, obsahující 10 ([4]triangulen)ových[10] a 15 šestičlenných ([5]triangulen)ových kruhů.[11] Roku 2021 pak byl vytvořen největší homolog triangulen, obsahující 28 propojených šestičlenných ([7triangulen])ových kruhů[12]
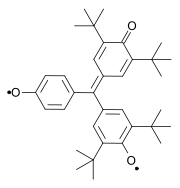
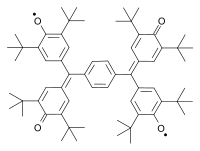
Další zkoumané biradikály jsou odvozené od pleiadenu,[13] rozšířených viologenů,[14][15] koranulenu,[16] nitronylnitroxidu,[17] bis(fenalenyl)ů[18] a teranthenů.[19][20]
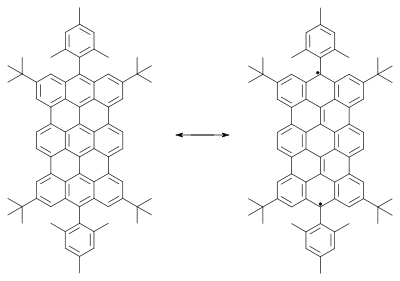 |
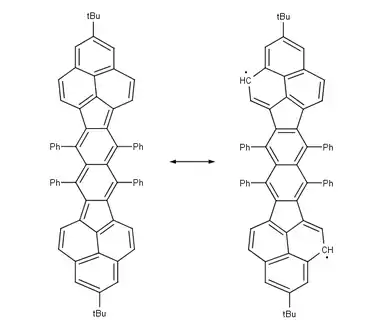 | |
| Teranthenový biradikál Singlet, max. 3 stabilizující Clarovy sextety, stabilní na vzduchu při pokojové teplotě, 50% biradikál, část struktury grafenu | Bisfenalenyl biradikál Singlet, max. 6 stabilizujících Clarových sextetů, stabilní na vzduchu při pokojové teplotě, 42% biradikál | |
Pleiaden byl vytvořen z acenaftylenu a kyseliny anthranilové s dusitanem amylnatým:
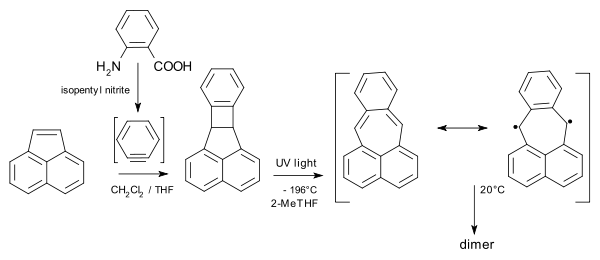 |
| Příprava a dimerizace pleiadenu |
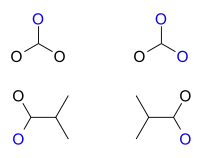
Oxyallylové biradikály
Oxyallylové biradikály jsou odvozeny od trimethylenethanu náhradou jedné methylenové skupiny atomem kyslíku. Objevují se při otevírání kruhů cyklopropanonů a allenoxidů a ve Favorského přesmycích. Vznikají reakcemi kyslíkových radikálových aniontů s acetonem a byly zkoumány fotoelektronovou spektroskopií.[21] Jejich elektronová afinita činí 1,94 eV.
Rozdělení
Nekekuovské molekuly se dvěma radikálovými centry (nekekulovské diradikály) lze dělit na nerozpojené a rozpojené podle tvaru jejich nevazebných molekulových orbitalů (NBMO).
U nerozpojených molekul, jako je trimethylenmethan, jsou oba NBMO na stejném atomu. Podle Hundova pravidla je každý orbital zaplněn jedním elektronem, u takovýchto molekul tak převažují tripletové základní stavy.
NBMO rozpojených molekul, například tetramethylenethanu, mají oproti tomu elektronovou hustotu na různých atomech. Destabilizace odpudivými Coulombovými silami je tak slabší než u nerozpojených molekul a relativní stabilita singletových a tripletových stavů je podobná, někdy i opačná.
Reference
- IUPAC Gold Book definitions of biradical and diradicals
- Robert A. Moss ed. (2004), "Reactive Intermediate Chemistry" (Book) Wiley-Interscience. ISBN 0-471-23324-2
- TSCHITSCHIBABIN, A. E. Über einige phenylierte Derivate des p, p-Ditolyls. Berichte der Deutschen Chemischen Gesellschaft. 1907, s. 1810–1819. Dostupné online. DOI 10.1002/cber.19070400282. (anglicky)
- MONTGOMERY, Lawrence K.; HUFFMAN, John C.; JURCZAK, Edward A.; GRENDZE JR, Martin P. The molecular structures of Thiele's and Chichibabin's hydrocarbons. Journal of the American Chemical Society. 1986, s. 6004–6011. DOI 10.1021/ja00279a056. PMID 22175364. (anglicky)
- YANG, N. C.; CASTRO, A. J. Synthesis of a stable biradical" n P. Grendze Jr. (1986), "The molecular structures of Thiele's and Chichibabin's hydrocarbons. Journal of the American Chemical Society. 1960, s. 6208. DOI 10.1021/ja01508a067. (anglicky)
- COPPINGER, G. M. A stable phenoxy radical inert to oxygen. Tetrahedron. 1962, s. 61–65. DOI 10.1016/0040-4020(62)80024-6. (anglicky)
- COPPINGER, G. M. Inhibition Reactions of Hindered Phenols. Journal of the American Chemical Society. 1964, s. 4385–4388. DOI 10.1021/ja01074a032. (anglicky)
- M. Baumgarten (2003/2004), "High spin molecules directed towards molecular magnets", chapter 12 in "EPR of free radicals in solids, Trends in methods and application", A. Lund, M. Shiotani (eds), Kluwer, pages 491-528
- Niko Pavliček; Anish Mistry; Zsolt Majzik; Nikolaj Moll; Gerhard Meyer; David J. Fox; Leo Gross. Synthesis and characterization of triangulene. Nature Nanotechnology. 2017-02-13, s. 308–311. Dostupné online. ISSN 1748-3395. DOI 10.1038/nnano.2016.305. PMID 28192389. Bibcode 2017NatNa..12..308P.
- Shantanu Mishra, Doreen Beyer, Kristjan Eimre, Junzhi Liu, Reinhard Berger, Oliver Gröning, Carlo A. Pignedoli, Klaus Müllen, Roman Fasel, Xinliang Feng, Pascal Ruffieux. Synthesis and Characterization of π-Extended Triangulene. Journal of the American Chemical Society. 2019-07-10, s. 10621–10625. Dostupné online. ISSN 0002-7863. DOI 10.1021/jacs.9b05319. PMID 31241927.
- SU, Jie; TELYCHKO, Mykola; HU, Pan; MACAM, Gennevieve; MUTOMBO, Pingo; ZHANG, Hejian; BAO, Yang. Atomically precise bottom-up synthesis of π-extended [5]triangulene. Science Advances. 2019-07-01, s. eaav7717. ISSN 2375-2548. DOI 10.1126/sciadv.aav7717. PMID 31360763. (anglicky)
- MISHRA, Shantanu; XU, Kun; EIMRE, Kristjan; KOMBER, Hartmut; MA, Ji; PIGNEDOLI, Carlo; FASEL, Roman. Synthesis and characterization of [7]triangulene. Nanoscale. 2021-01-07, s. 1624–1628. Dostupné online. DOI 10.1039/D0NR08181G. PMID 33443270. (anglicky)
- KOLC, Jaroslav; MICHL, Josef. π,π-Biradicaloid hydrocarbons. Pleiadene family. I. Photochemical preparation from cyclobutene precursors. Journal of the American Chemical Society. 1973, s. 7391–7401. DOI 10.1021/ja00803a030. (anglicky)
- WILLIAM, W. Porter III; VAID, Thomas P.; RHEINGOLD, Arnold L. Synthesis and characterization of a highly reducing neutral "extended viologen" and the isostructural hydrocarbon 4,4''''-di-n-octyl-p-quaterphenyl. Journal of the American Chemical Society. 2005, s. 16559–16566. DOI 10.1021/ja053084q. PMID 16305245. (anglicky)
- CASADO, J.; PATCHKOVSKII, S.; ZGIERSKI, M.; HERMOSILLA, L.; SIEIRO, C.; OLIVA, M. Moreno; NAVARRETE, J. López. Raman Detection of "ambiguous" conjugated biradicals: Rapid thermal singlet-to-triplet intersystem crossing in an extended viologen. Angewandte Chemie International Edition. 2008, s. 1443–1446. DOI 10.1002/anie.200704398. PMID 18200638. (anglicky)
- UEDA, A.; NISHIDA, S.; FUKUI, K.; ISE, T.; SHIOMI, D.; SATO, K.; TAKUI, T. Three-dimensional intramolecular exchange interaction in a curved and nonalternant π-conjugated system: Corannulene with two phenoxyl radicals. Angewandte Chemie International Edition. 2010, s. 1678–1682. DOI 10.1002/anie.200906666. PMID 20108294. (anglicky)
- ZIESSEL CHRISTOPHE STROH, Raymond; HEISE, Henrike; KÖHLER, Frank H.; TUREK, Philippe; CLAISER, Nicolas; SOUHASSOU, Mohamed; LECOMTE, Claude. Strong Exchange Interactions between Two Radicals Attached to Nonaromatic Spacers Deduced from Magnetic, EPR, NMR, and Electron Density Measurements. Journal of the American Chemical Society. 2004, s. 12604–12613. DOI 10.1021/ja0305959. PMID 15453793. (anglicky)
- KUBO, Takashi; SHIMIZU, Akihiro; URUICHI, Mikio; YAKUSHI, Kyuya; NAKANO, Masayoshi; SHIOMI, Daisuke; SATO, Kazunobu. Singlet biradical character of phenalenyl-based kekulé hydrocarbon with naphthoquinoid structure. Organic Letters. 2007, s. 81–84. DOI 10.1021/ol062604z. PMID 17192090. (anglicky)
- KONISHI, Akihito; HIRAO, Yasukazu; NAKANO, Masayoshi; SHIMIZU, Akihiro; BOTEK, Edith; CHAMPAGNE, Benot; SHIOMI, Daisuke. Synthesis and characterization of teranthene: A singlet biradical polycyclic aromatic hydrocarbon having Kekulé structures. Journal of the American Chemical Society. 2010, s. 11021–11023. DOI 10.1021/ja1049737. PMID 20698663. (anglicky)
- LAMBERT, C. Towards polycyclic aromatic hydrocarbons with a singlet open-shell ground state. Angewandte Chemie International Edition. 2011, s. 1756–1758. DOI 10.1002/anie.201006705. PMID 21284072. (anglicky)
- ICHINO, Takatoshi; VILLANO, Stephanie M.; GIANOLA, Adam J.; GOEBBERT, Daniel J.; VELARDE, Luis; SANOV, Andrei; BLANKSBY, Stephen J. The lowest singlet and triplet states of the oxyallyl diradical. Angewandte Chemie International Edition. 2009, s. 8509–8511. Dostupné online. DOI 10.1002/anie.200904417. PMID 19739188. (anglicky)
V tomto článku byl použit překlad textu z článku Non-Kekulé molecule na anglické Wikipedii.